Neuartiger Konstruktionsplan für Filamente
Max-Planck-Wissenschaftler klären auf, wie sich Septin-Filamente bilden
Anzeigen
Ob Zellen sich korrekt teilen, Enzyme als Signalgeber fungieren oder Botenstoffe aus Zellen ausgeschleust werden, entscheidend für die Funktion biologischer Moleküle sind ihre Bausteine und deren dreidimensionale Anordnung. Forscher der Max-Planck-Institute in Dortmund und Göttingen haben jetzt den universellen Bauplan einer noch wenig erforschten Proteinklasse, der Septin-Filamente, entschlüsselt. Diese Proteine sind zelluläre Verwandlungskünstler, die mithilfe ihrer Strukturen an wichtigen biologischen Prozessen beteiligt sind, wie beispielsweise an der Zytogenese oder am Stofftransport durch die Zelle. Überraschenderweise ist der Filamentaufbau der Septine grundlegend anders als bislang vermutet und weist keine Ähnlichkeit mit anderen hierarchisch aufgebauten, faserartigen Strukturen in biologischen Systemen auf.
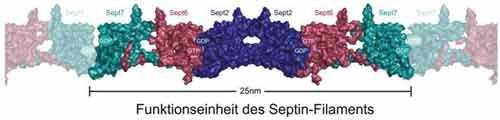
Kleinstes Glied der Kette: Die Dopplung der drei Untereinheiten SEPT2, SEPT6 und SEPT7 bildet das sich wiederholende Grundelement, ein Hexamer, die kleinste Funktionseinheit der Septine. Eines dieser Hexamere ist 2,5 Millionstel Millimeter lang. Aneinander gereiht entstehen daraus lange Fasern, die sich - je nach Funktion - weiter zu Ringen oder komplexen Netzwerken anordnen können. Diese Protein-Ketten können sich nach beiden Enden gleichermaßen verlängern - ein bislang neuartiges Bauprinzip zellulärer Filamentproteine.
MPI für Molekulare Physiologie / Wittinghofer
Um ihre biologische Funktion zu erfüllen, falten sich Proteine in eine dreidimensionale Struktur. Lagern sich einzelne gefaltete Proteine zu größeren Bauelementen zusammen, und reihen sich diese Einheiten wiederum wie Perlen zu einer Kette auf, entstehen Fasern mit einer komplexen Geometrie, wie Zellen sie für ihr Zytoskelett und zur Zellteilung benötigen. Bekannte und gut untersuchte Vertreter sind beispielsweise Aktinfilamente und Mikrotubuli. Ähnlich komplex, jedoch weitaus weniger erforscht als die Proteine des Zytoskeletts, sind die Septine. Diese Proteine wurden vor über 35 Jahren in Zellen der Bäckerhefe entdeckt.
Hefezellen vermehren sich, indem sich Tochterzellen von einer Mutterzelle abschnüren. Bei dieser Art der Zellteilung bilden die Septine eine ringförmige Struktur, die die Teilungsebene, das Septum, kennzeichnet. Das war der Ursprung für die Namensgebung dieser ungewöhnlichen Filamente. "Zwanzig Jahre lang hielt man Septine für typische Proteine der Hefe und anderer Pilze. Heute weiß man, dass Septine in praktisch allen Organismen außer Einzellern und Pflanzen vorkommen", erklärt Alfred Wittinghofer. Worin genau ihre Funktionen bestehen, ist weitgehend unerforscht. Sicher scheint, dass Septine essenziell für die Zellteilung und die Organisation des Zytoskeletts sind. Aber auch im Gehirn finden sich Septine in großer Menge; hier sind sie unter anderem am Transport von Vesikeln und damit an der Freisetzung von Botenstoffen wie Dopamin und Serotonin beteiligt.
Septine können ihre verschiedenen Funktionen ausführen, indem sie untereinander und mit anderen Proteinen interagieren. Dabei bilden die kleinen Septine zunächst miteinander größere Komplexe. Diese werden schließlich zu langen Strängen, den Filamenten, verknüpft. Diese Filamente können - je nach Zelltyp und Funktion - unterschiedliche Formen annehmen: Sie erscheinen als stäbchenförmige Strukturen, können sich wie bei der Zellteilung zu Ringen formen oder zu komplexen Netzwerken verflechten. Die Formen entstehen sehr schnell und dynamisch; je nach Bedarf werden Filamente laufend auf- und wieder abgebaut.
Die Forscher um Alfred Wittinghofer nutzen nun erstmals die Röntgenkristallographie, um die Struktur der Filamente zu analysieren. Dabei werden die Septine zunächst kristallisiert und anschließend mit Röntgenstrahlen durchleuchtet. Die Röntgenstrahlen lassen ein Beugungsmuster entstehen, mit dessen Hilfe ein Computer errechnet, wo die Atome im Kristall liegen und wie das Protein somit strukturiert ist. "Mithilfe des Elektronenmikroskops konnten wir dann die 3-D Modelle der Kollegen bestätigen", erklärt Holger Stark vom Max-Planck-Institut für biophysikalische Chemie.
Die Lage der Atome im Filament verriet den Forschern, dass sich immer sechs Septin-Moleküle aneinanderreihen und damit das kleinste Konstruktionselement für die Filamente bilden. Die beiden Sept-2 Moleküle in der Mitte fügen sich seitenverkehrt und Kopf-an-Kopf aneinander. Alle Septine binden sich dabei an die G-Domäne des anderen. In der G-Domäne binden sich die Nukleotide Guanosintriphosphat (GTP) und Guanosindiphosphat (GDP) aneinander. Diese Bindungsstelle ist in allen menschlichen Septinen praktisch identisch. Zu beiden Seiten der G-Domäne befinden sich jedoch Regionen, die sehr unterschiedlich geformt sein können. Viele Septine sind an einem Ende spiralig aufgefaltet. Diese Doppelwendel-Strukturen sind auch in vielen anderen Proteinen zu finden. "Bisher hatte man angenommen, dass das spirale Ende verantwortlich ist für die Bildung der Septin-Filamente", so Wittinghofer: "Doch diese Annahme wird jetzt durch unsere Erkenntnisse revidiert." Die Aufnahmen der Forscher zeigten auch, dass die Verbindungsstelle zwischen den beiden SEPT2-Elementen räumlich flexibel ist, so dass längere Filamente beispielsweise zu einem Ring gebogen werden können, ohne zu brechen. "Das erklärt erstmals, warum die Septin-Filamente in so vielen Formen vorkommen und dadurch ihre vielen Aufgaben erfüllen können", erklärt Stark.
Originalveröffentlichung: Minhajuddin Sirajuddin, Marian Farkasovsky, Florian Hauer, Dorothee Kühlmann, Ian G. Macara, Michael Weyand, Holger Stark, Alfred Wittinghofer; "Structural insight into filament formation by mammalian septins"; Nature, 19. Juli 2007.