Enzyme im Labor nachgebaut
Katalysatorforschung nach dem Vorbild der Natur
Den Frankfurter Chemikern um Prof. Magnus Rueping ist es gelungen, Katalysatoren nach dem Vorbild der Natur zu synthetisieren. In der neuen Ausgabe von "Forschung Frankfurt" berichten sie, wie die robusten und gut zugänglichen Verbindungen die industrielle Synthese von Aminen vereinfachen.
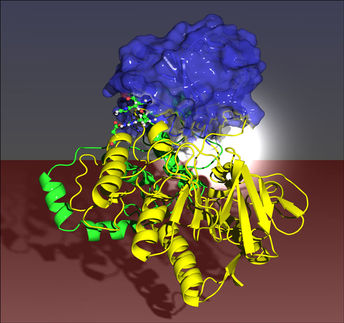
Als Modell diente die Glutamat-Dehydrogenase (GDH), ein wichtiges Enzym im Stickstoffzyklus. Es katalysiert die Reaktion von Ammonium-alpha-Ketogluterat und NADH zur Aminosäure Glutamat und NAD+. Beide lagern sich nach dem Schlüssel-Schloss-Prinzip an das aktive Zentrum des Katalysators an. Eine Besonderheit ist in diesem Fall, dass das Reaktionsprodukt auch Chiralität besitzt. Da beide Enantiomere unterschiedliche chemische Eigenschaften besitzen ist es wichtig, dass nur eine Sorte Enantiomer entsteht. Die dazu notwendige asymmetrische Synthese im Labor nachzuahmen ist außerordentlich schwierig, aber von großer technischer Bedeutung.
Inspiriert vom natürlichen Vorbild der Glutamat-Dehydrogenase (GDH) wählte Rueping beim Nachbau des Katalysators als Grundstruktur ein chirales Molekül - das BINOL-Phosphat - und versah es mit vier verschiedenen Seitenketten. An Stelle des in Lebewesen vorkommenden Protonenspenders NADH setzte er das im Labor gebräuchliche Hantzsch-Dihydropyridin ein. Auf diesem Weg entstanden Amine, die man bisher im Labor nur unter hohem Wasserstoffdruck und der Verwendung metallhaltiger Katalysatoren hatte synthetisieren können. Für die Wirkstoffsynthese, in der Amine eine wichtige Rolle spielen, war die Verwendung solcher Katalysatoren aufgrund ihrer toxischen Eigenschaften bedenklich erschienen.
Anders als sein biologisches Vorbild kann der synthetische Katalysator ein breiteres Reaktionsspektrum katalysieren und ist auch robuster - das heißt, er arbeitet nicht ausschließlich bei 37 Grad und in wässriger Umgebung. Ermutigt durch diese Erfolge hat der Frankfurter Degussa-Stiftungsprofessor das Prinzip der Säure-katalysierten Transferhydrierung, wie es nach dem Vorbild der GDH realisiert wurde, inzwischen auch auf die Synthese von Chinolin-Derivaten angewendet. Diese Stoffklasse ist von großem Interesse für die Chemie, Pharmazie und die Materialwissenschaften. Bisher konnten solche Systeme nur durch lange Syntheserouten enantiomerenrein erhalten werden. Die Ergebnisse sind außerordentlich vielversprechend: Bereits die geringe Menge von einem Katalysatormolekül auf 10.000 Substratmoleküle reicht aus, um eine enantiomerenselektive Reduktion zu katalysieren - das ist die bis heute niedrigste Katalysatormenge, die jemals für eine solche Reaktion eingesetzt wurde. Daraus lässt sich das große Potential der chiralen BINOL-Phosphate für industrielle Anwendungen erschließen.
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.