Die Stellschrauben der Signalstärke
Wie Nervenzellen ihre Empfindlichkeit regeln
Die Kommunikation zwischen Nervenzellen unterliegt Steuerungsmechanismen, die komplizierter zusammenwirken als bisher angenommen. Biochemiker der Ruhr-Universität Bochum (Lehrstuhl für Biochemie I - Rezeptorbiochemie, Prof. Dr. Michael Hollmann) beschrieben die Wirkung von vier verschiedenen Proteinen einer Familie, die auf unterschiedliche Untergruppen von Glutamatrezeptoren wirken und die Empfindlichkeit des Rezeptors regulieren. Je nachdem, welches Protein mit welcher Untereinheit interagierte, ergaben sich ganz individuelle, teils unerwartete Auswirkungen. "Unsere Ergebnisse zeigen, dass es essenziell sein wird, den Mechanismus dieser Interaktion aufzuklären, um potenzielle neue Ansatzpunkte für die Behandlung von neuronalen Krankheiten zu gewinnen, die auf glutamaterger Übererregung von Neuronen basieren, wie etwa Epilepsie oder die sekundären Zellschäden bei Parkinson", erklärt Prof. Hollmann.
Wenn Nervenzellen miteinander kommunizieren, setzt die "Senderzelle", die eine Nachricht absetzen will, einen Botenstoff frei. Im menschlichen Gehirn ist das meistens die Aminosäure Glutamat, eine Chemikalie, die landläufig aus der Lebensmitteltechnik als Geschmacksverstärker bekannt ist. Dieser Botenstoff diffundiert zur benachbarten "Empfängerzelle" und bindet dort an ein "Empfängermolekül", den Glutamatrezeptor. Durch Bindung des Botenstoffes L-Glutamat öffnet dieser Rezeptor ein Membrantor, wodurch es zu einem Einstrom von positiv geladenen Ionen in die Zelle kommt, womit dann "die Botschaft" in der Empfängerzelle angekommen ist.
Zur Steuerung der Empfangsempfindlichkeit, der Signalstärke und der Signalfrequenz, in der die Botschaft kodiert ist, verfügen Nervenzellen über eine ganze Reihe von molekularen Mechanismen, die Signalverarbeitung durch den Rezeptor an bestimmte Erfordernisse anzupassen. Eine Untergruppe der Glutamatrezeptoren, die sog. AMPA-Rezeptoren, haben dazu einen erst kürzlich entdeckten Mechanismus entwickelt, der auf der Rezeptormodulation durch eine neue Klasse von Proteinen beruht, den TAR-Proteinen (TARPs, für transmembrane AMPA-Rezeptor-regulierende Proteine). Die Familie der TAR-Proteine verändert sowohl die Zahl der Rezeptoren auf einer Empfängerzelle als auch deren spezifische Eigenschaften. "Gegenstand unserer Forschung ist die Veränderung der Stärke und Frequenz der an AMPA-Rezeptoren hervorgerufenen Signale durch TARPs", erläutert Sabine Kott. "Dieses Thema ist von besonderer Bedeutung, da eine Veränderung der Signalverarbeitung einen kritischen Einfluss auf die Prozessierung von Informationen im Gehirn hat und somit Prozesse wie Denken, Fühlen und Erinnerung beeinflusst."
In der jetzt veröffentlichten Arbeit zeigen die Forscher zum ersten Mal, dass der Einfluss der Interaktion eines TARPs auf einen AMPA-Rezeptor sowohl von dem beteiligten TARP - es gibt vier verschiedene - als auch vom jeweiligen AMPA-Rezeptor abhängt - auch dort gibt es vier verschiedene Gene, sowie zusätzliche Spleiß- sowie Edier-Varianten. "Jede Kombination zeigte ein ganz individuelles Muster der Auswirkungen der Interaktion. Das war nach den bisher veröffentlichten Daten nicht zu erwarten", so Prof. Hollmann. In umfangreichen Versuchsreihen an Froscheiern haben die Biochemiker erstmals den Einfluss aller TARPs auf die Erhöhung der Glutamat-induzierten Stromantworten aller vier AMPA-Rezeptoren sowie aller gängigen Spleiß- sowie Edier-Varianten beschrieben. Somit konnten sie auch die bislang unerkannten Auswirkungen von Spleiß- und Edier-Varianten auf die Interaktion von TARPs und AMPA-Rezeptoren definieren.
"Was wir im Gegensatz zu bislang veröffentlichten Publikationen eindeutig nachweisen konnten, ist die Tatsache, dass der Wirkungsgrad der TARPs kritisch von der AMPA-Rezeptoruntereinheit abhängt", fasst Sabine Kott zusammen. "Ebenso treten bei Kombinationen aus mindestens zwei unterschiedlichen Untereinheiten andere Wirkungsgrade der TARPs auf als bei den jeweiligen homomer vorliegenden Untereinheiten." Der Wirkungsgrad der TARPs auf heteromere (gemischte) AMPA-Rezeptorkombinationen ist nicht, wie man erwarten könnte, die Summe oder ein Querschnitt aus den Wirkungsgraden der einzelnen Untereinheiten, was eine unerwartete weitere Komplexitätsebene hinzufügt.
Originalveröffentlichung: Kott S, Werner M, Körber C, Hollmann M.: "Electrophysiological properties of AMPA receptors are differentially modulated depending on the associated member of the TARP family."; Journal of Neuroscience 2007 Apr. 4;27(14):3780-9.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
PAION AG: Veränderung im Vorstand

Forschungsarbeit zur erlernten Bewegung der Gliedmaßen gewinnt den Eppendorf & Science Prize 2014
DESY-Röntgenquelle findet vielversprechende Kandidaten für Coronamedikamente - Bereits bekannte Wirkstoffe binden an Schlüsselprotein des Virus
Wimperung
MOLOGEN AG erhält auch in Japan Patentschutz für die zellbasierte Krebstherapie MGN1601

Remote Control Deutschland - Kaarst, Deutschland
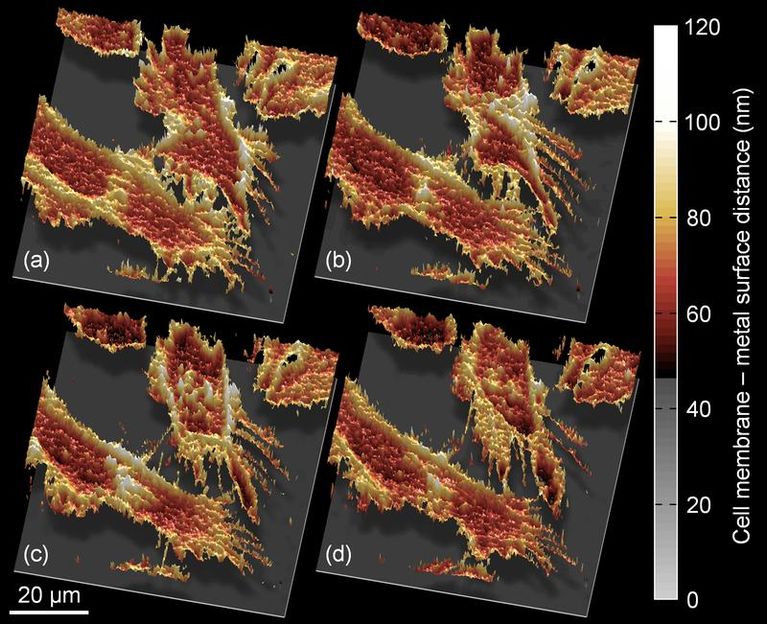
Zellbewegungen in höchster Auflösung beobachten - Wissenschaftler der Universität Göttingen entwickeln neues optisch-spektroskopisches Verfahren
Diogenes_von_Apollonia

Kein Konkurrent für Brot und Milch - Der Energieträger Biomasse wird immer wichtiger.
Nervenzellen im Schilderwald
Ernst_Gaupp