Licht steuert Nervenzellen
Max-Planck-Wissenschaftler entwickeln in Zusammenarbeit mit Frankfurter und US-amerikanischen Universitäts-Kollegen ein neues Werkzeug für die Neurobiologie
Anzeigen
In einer Kooperation mit Kollegen von der Stanford University und der Universität Frankfurt ist es Wissenschaftlern vom Max-Planck-Institut für Biophysik in Frankfurt gelungen, ein Werkzeug zu entwickeln, mit dem sich Nervenzellen in lebendem Gewebe innerhalb von Millisekunden an- und wieder abschalten lassen. Als Schalter fungieren dabei ein aus einer Alge stammender lichtaktivierbarer Ionenkanal sowie eine ebenso durch Licht gesteuerte Ionenpumpe aus einem Archaebakterium. Beide gehören zur Klasse der mikrobiellen Rhodopsine, in die - wie beim Sehpurpur im menschlichen Auge - der Chromophor Retinal eingebunden ist. Die entsprechenden Gene wurden in Nervenzellen eingeschleust und führten dort zur Bildung funktioneller Proteine. Durch gezielte Aktivierung der Rhodopsine mit Licht unterschiedlicher Wellenlänge konnten die Forscher die Zellen unabhängig voneinander an- und abschalten. Durch diese Manipulation der neuronalen Botschaften wird es nun möglich, die Rolle bestimmter Zellen in neuronalen Netzen zu erforschen. Die Wissenschaftler konnten ihr neues Werkzeug bereits am lebenden Tier testen: dem kleinen Fadenwurm C. elegans.
Zwei unscheinbare Mikroben haben den Wissenschaftlern vom Max-Planck-Institut für Biophysik in Frankfurt/Main und ihren Kollegen von der Univ. Frankfurt und der Stanford University in USA nun weitergeholfen: Dabei handelt es sich um das Archaebakterium Natronomonas pharaonis sowie die kleine Grünalge Chlamydomonas reinhardtii. Chlamydomonas besitzt einen als Channelrhodopsin-2 bezeichneten Ionenkanal (ChR2), der ursprünglich 2003 am Max-Planck-Institut für Biophysik charakterisiert wurde. Überträgt man das entsprechende Gen per Virus-Shuttle in Nervenzellen, so lässt sich der Kanal dort durch Licht in einem bestimmten Wellenlängenbereich (blau) aktivieren. Der daraus resultierende Einwärtsstrom von Kationen führt zu einer Depolarisation der Zellen und damit zur Auslösung von Aktionspotenzialen (Spikes) - die Nervenzellen werden quasi angeschaltet. Sobald der Lichtpuls aussetzt, schließt sich der Kanal wieder. Die elektrischen Botschaften der Nervenzellen - kodiert in der Spike-Frequenz - können also durch einen einfachen Lichtpuls gesteuert werden. Bereits 2005 hatten Alexander Gottschalk von der Universität Frankfurt, Georg Nagel - damals noch in der Abteilung Biophysikalische Chemie des Max-Planck-Instituts für Biophysik - und Ernst Bamberg (Direktor am MPI für Biophysik) mit ihren jeweiligen Mitarbeitern gezeigt, dass sich auf diese Weise in dem kleinen Fadenwurm Caenorhabditis elegans sogar Verhaltensantworten auslösen lassen.
Diese Vorgehensweise erlaubte jedoch nur eine Aktivierung der Zellen. Auf der Wunschliste der Forscher ganz oben stand daher ein Werkzeug, das es ermöglicht, Nervenzellen mit der gleichen zeitlichen Präzision, nämlich innerhalb von Millisekunden, abzuschalten - und zwar über einen Lichtpuls anderer Farbe. Im Fokus der Forscher: die Chloridpumpe Halorhodopsin. Ernst Bamberg hatte dieses Protein bereits früher mit Hilfe elektrischer Methoden detailliert auf seine Transporteigenschaften untersucht, und Georg Nagel war es in der Folge gelungen, Halorhodopsin aus Natronomonas pharaonis (NpHR) erstmals in tierischen Zellen zu exprimieren. Wurden die Zellen mit gelbem Licht beleuchtet, so kam es zu einem Einwärtsstrom von Chloridionen und infolgedessen zu einer Hyperpolarisation, die Aktionspotenziale hemmt.
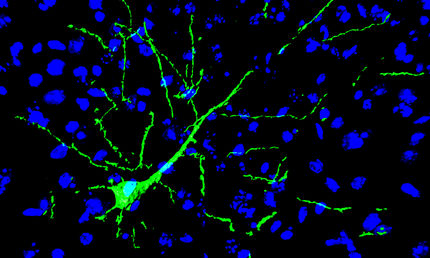
Die Kollegen in Stanford fusionierten das NpHR-Gen mit einem fluoreszierenden Protein (eYFP) und schleusten es wiederum per Virus-Shuttle in kultivierte Hippocampus-Nervenzellen ein. Sie konnten nun mit gelbem Licht einzelne Aktionspotenziale ebenso wie eine ganze Salve von Spikes unterbinden. In einem nächsten Schritt verknüpften sie Channelrhodopsin-2 mit einer rot fluoreszierenden Protein-Variante (mCherry) und koexprimierten den Kanal aus der Alge und die Pumpe aus dem Archaebakterium in Hippocampus-Neuronen. Tatsächlich war es nun möglich, das Membranpotenzial in ein und demselben Neuron in beide Richtungen zu verändern: Blaue Lichtpulse lösten durch Aktivierung von ChR2 Aktionspotenziale aus, während gelbe Lichtpulse durch Aktivierung von NpHR die Aktionspotenziale löschten.
Eine wichtige, noch zu beantwortende Frage war, ob mit diesem System auch das Verhalten eines Tieres in vivo kontrolliert werden kann. Für Channelrhodopsin-2 war das ja bereits für die Taufliege Drosophila und den Fadenwurm C. elegans gezeigt worden. Wieder arbeiteten die Max-Planck-Wissenschaftler mit dem Team des C. elegans-Experten Alexander Gottschalk zusammen. Wurde die Chloridpumpe NpHR in Nerven- oder Muskelzellen von C. elegans exprimiert, so führte Lichtaktivierung zum unmittelbaren Stopp (innerhalb von 150 Millisekunden) der Schwimmbewegungen. Nach Beendigung des Lichtreizes kehrte der kleine Fadenwurm zu seinem natürlichen Schwimmverhalten zurück.
Originalveröffentlichung: Feng Zhang, Li-Ping Wang, Martin Brauner, Jana F. Liewald, Kenneth Kay, Natalie Watzke, Phillip G. Wood, Ernst Bamberg, Georg Nagel, Alexander Gottschalk & Karl Deisseroth; "Multimodal fast optical interrogation of neural circuitry"; Nature 2007.