Aktivierende Sprossen
Anzeigen
In der Zelle falsch platzierte DNA löst eine Immunreaktion aus. Dafür bildet sie mit einem immunstimulierenden Enzym eine leiterähnliche Struktur, die mehrere Sprossen haben muss, wie LMU-Wissenschaftler zeigen.
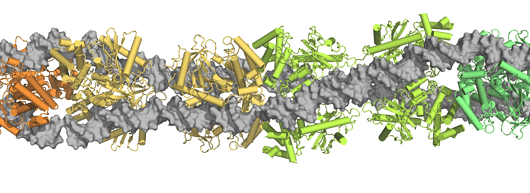
Komplex aus DNA und cGAS-Dimeren.
K.-P. Hopfner, LMU
In den Zellen höherer Organismen findet man das Erbmolekül DNA normalerweise ausschließlich im Zellkern und in den Mitochondrien. Kommt DNA auch als sogenannte zytosolische DNA in der Zellsubstanz vor, stammt sie meist aus einer Infektion mit Bakterien oder DNA-Viren, aber auch aus geschädigten Mitochondrien, etwa nach einer Strahlentherapie bei Krebs. Das Enzym cGAS identifiziert die fehlplatzierte DNA und stößt eine starke Immunreaktion an. Ein Team um Professor Karl-Peter Hopfner hat nun in Kooperation mit Professor Veit Hornung (beide Genzentrum der LMU) und Professor Heinrich Leonhardt (Fakultät für Biologie) aufgeklärt, warum die Länge der zytosolischen DNA dabei eine wichtige Rolle spielt: DNA und cGAS bilden eine leiterähnliche Struktur – und erst bei einer bestimmten Länge der Leiter wird das Immunsystem aktiviert.
Das Enzym cGAS bildet ein Dimer, d.h. einen Zweierverbund aus zwei cGAS-Molekülen. In dieser Form bindet es an zytosolische DNA, wodurch ein zyklisches Zwischenprodukt entsteht, das die Bildung immunstimulierender Interferone anstößt. Wie frühere Studien zeigten, ist dieser Prozess bei längeren DNA-Strängen deutlich effizienter als bei kurzen, auch wenn die Gesamtmenge an zytosolischer DNA gleich ist.
„Um zu untersuchen, wie cGAS die DNA-Länge detektiert, haben wir einen Komplex aus cGAS-Dimeren und längerer zytosolischer DNA kristallisiert und dessen Struktur aufgeklärt“, sagt Hopfner. Dabei zeigte sich, dass der Komplex eine leiterähnliche Struktur hat, wobei die DNA die Seitenteile der Leiter bildet und die Dimere einzelne Sprossen. Bei den „Seitenteilen“ kann es sich dabei grundsätzlich sowohl um zwei verschiedene Stränge, als auch um einen U-förmig gebogenen, einzelnen DNA-Strang handeln. Erst durch diese Leiterform werden die Dimere stabil genug, um die Immunreaktion anzustoßen: „Je mehr Leitersprossen dazukommen, desto stabiler wird der Komplex, da sich benachbarte Dimere gegenseitig stabilisieren“, sagt Liudmila Andreeva, die Erstautorin der Studie. „Wir haben sogar ein mathematisches Modell entwickelt, das diesen Mechanismus erklärt.“
Ist der DNA-Strang nur kurz, sodass sich nur eine Leitersprosse ausbilden kann, ist das Konstrukt zu instabil und zerfällt wieder. „Es ist wie bei einem Reißverschluss: Wenn man nur einen Haken hätte, wäre das ganze instabil, aber viele Haken halten den Reißverschluss zusammen und man kann ihn auch nicht in der Mitte aufmachen“, erklärt Hopfner. Bestimmte Proteine können die Initiierung der Leiterstruktur erleichtern, indem sie die DNA-Struktur so beeinflussen, dass sich Schleifen bilden, zwischen denen erste Dimer-Sprossen entstehen, denen dann weitere folgen. Dabei konnte das Team zeigen, dass Proteine, die für die zelluläre Stressantwort und die DNA-Verpackung eine wichtige Rolle spielen, von cGAS besonders gut erkannt werden.
Nach Ansicht der Wissenschaftler kann die für eine Aktivierung erforderliche DNA-Mindestlänge und die Schleifenstrukturen helfen, Fehlalarme zu vermeiden: Kurze DNA-Abschnitte im Zytosol können auch aus zahlreichen körpereigenen Quellen stammen. Um gezielt Pathogene abzuwehren, könnte es daher vorteilhaft sein, wenn das Immunsystem auf längere DNA-Abschnitte effektiver reagiert.






















































