Biochemiker beobachten Enzyme bei der Arbeit
Zusammenspiel von Enzym-Domänen während der Katalyse entschlüsselt
Viele pharmazeutisch wichtige Wirkstoffe stammen aus Pflanzen, Pilzen oder Bakterien. Man isoliert die Substanzen aus den "biologischen Produzenten", da ihre chemische Herstellung im Labor zu aufwendig ist. Um die Naturstoffproduktion zu verstehen, analysieren Forscher die komplexen Enzym-Apparate, die in den Zellen der Organismen als Produktionsmaschinen dienen. Eine Idee ist, sich diese Mechanismen für die Herstellung neuer Wirkstoffe zunutze zu machen. Auch die Arbeitsgruppe von Prof. Dr. Henning Mootz am Institut für Biochemie der Westfälischen Wilhelms-Universität Münster (WWU) widmet sich dieser Aufgabe. Nun stellen die münsterschen Biochemiker in Zusammenarbeit mit Wissenschaftlern der Universität Princeton (USA) und der Hokkaido-Universität (Japan) grundlegend neue Erkenntnisse zum Zusammenspiel der verschiedenen Komponenten dieser Enzym-Apparate vor.

Florian Mayerthaler, Jennifer Rüschenbaum und Prof. Dr. Henning Mootz (v. l.) vom Institut für Biochemie der WWU. Im Hintergrund sind dynamische Strukturänderungen der Domänen bei der Peptidproduktion schematisch dargestellt.
© Dr. Wolfgang Dörner
Die Biochemiker untersuchten die Produktion – die "enzymatische Biosynthese" – sogenannter nicht-ribosomaler Peptide. Ähnlich wie andere Peptide und Proteine in den Zellen sind diese aus einzelnen Aminosäuren aufgebaut. Die Bezeichnung "nicht-ribosomal" bezieht sich auf den Produktionsort in der Zelle. Im Gegensatz zu den meisten anderen Proteinen ist die Herstellung dieser Peptide nicht an spezielle Strukturen in der Zelle, die Ribosomen, gebunden.
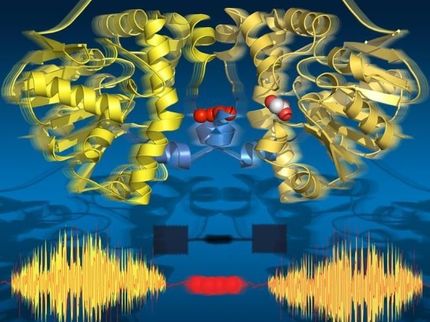
Unter den nicht-ribosomalen Peptiden sind bekannte Antibiotika wie Penicillin und Vancomycin sowie Wirkstoffe, die als Immunsuppressivum oder als Krebsmedikament zum Einsatz kommen. Als Produktionsmaschinen für diese Peptide fungieren spezielle sehr große Enzyme, die "nicht-ribosomalen Peptid-Synthetasen". Sie zeichnen sich durch zahlreiche hintereinandergeschaltete Produktionseinheiten aus, fachsprachlich katalytische Domänen genannt. Ähnlich wie bei einem Fließband in einer Autofabrik trägt jede Domäne einen Teil zu der schrittweisen Herstellung des aus mehreren Bausteinen bestehenden Peptids bei. Dieses Herstellungsprinzip ermöglicht die Verwendung vieler verschiedener Peptidbausteine.
Bisher verstehen Wissenschaftler kaum, wie die einzelnen katalytischen Domänen in dieser zellulären Synthese-Maschine zusammenarbeiten. Die Münsteraner haben nun zum ersten Mal das Zusammenspiel der Domänen während der Katalyse entschlüsselt. Während einzelner Schritte der Peptidproduktion beobachteten sie dynamische Strukturänderungen der Domänen. "Das ist vergleichbar mit einem Roboterarm, der in der Autofabrik ein Bauteil zur nächsten Station weiterreicht", veranschaulicht Prof. Dr. Henning Mootz. "Wir konnten den Enzymen buchstäblich bei der Arbeit zuschauen."
Die Studie zeige einen neuen Weg zur Analyse dieser bedeutenden Enzym-Apparate, so die Forscher, und liefere grundlegende Erkenntnisse über ihre Funktionsweise. "Diese Arbeiten werden einen Beitrag dazu leisten, in Zukunft neue pharmazeutische Verbindungen biotechnologisch von Mikroorganismen herstellen zu lassen, anstatt sie aufwendig über viele Schritte künstlich herzustellen", unterstreicht Henning Mootz. Für eine Anwendung dieser grundlegenden Erkenntnisse wird allerdings noch weitere Forschungsarbeit nötig sein.
Die Forscher nutzten für ihre Untersuchungen aus Kolibakterien gewonnene nicht-ribosomale Peptid-Synthetasen. Um die molekularen Prozesse sichtbar zu machen, kombinierten sie verschiedene molekularbiologische und proteinchemische Methoden. Außerdem führten sie spektrometrische Fluoreszenzmessungen durch, um Abstände innerhalb der Enzymstrukturen zu bestimmen – vergleichbar mit einem molekularen Zollstock. Um das Zusammenspiel der Domänen zu beobachten, bauten sie zwei fluoreszente Sonden in die katalytischen Domänen ein.