RNA-Moleküle haben ein kurzes Leben
Halbwertszeit von RNA-Molekülen messen
Eine Forschungsgruppe am Biozentrum der Universität Basel hat eine neue Methode entwickelt, um die Halbwertszeit von RNA-Molekülen zu messen. Dabei zeigte sich, dass gängige Methoden verzerrte Messergebnisse liefern und RNA-Moleküle durchschnittlich nur zwei Minuten leben, zehnmal kürzer als bislang angenommen.
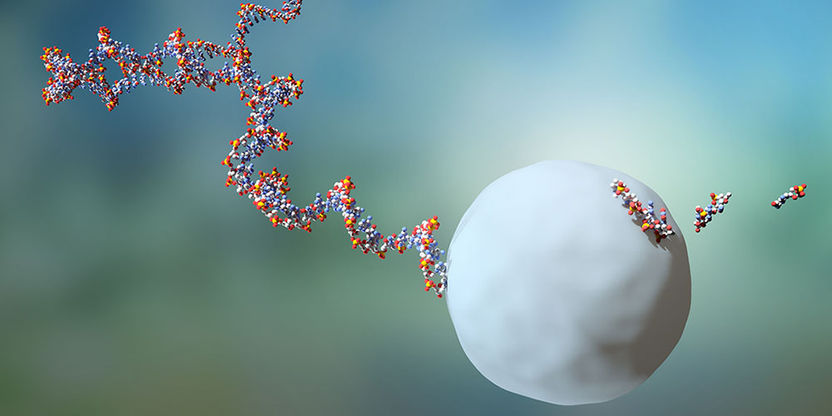
RNA-Moleküle leben durchschnittlich zwei Minuten bevor sie von einem Exosom eliminiert werden.
University of Basel, Biozentrum
RNA-Moleküle sind einzelne Abschriften der DNA einer Zelle. Sie übertragen die genetischen Informationen der DNA und dienen als Vorlage für die Herstellung von Proteinen, die sämtliche Prozesse in der Zelle steuern. Reguliert werden diese kleinen Informationsüberträger über ihre Lebenszeit, besser gesagt Halbwertszeit. Nach ihrer Herstellung dienen RNA-Moleküle für eine begrenzte Zeit als Vorlage für die Proteinproduktion, bevor sie wieder abgebaut werden.
Bislang gab es zwei wissenschaftliche Methoden, mit denen man die Halbwertszeit der RNAs gemessen hat. Wie das Forschungsteam von Prof. Attila Becskei am Biozentrum, Universität Basel, nun herausfand, können diese herkömmlichen Methoden ziemlich ungenau sein und teilweise inkonsistente Ergebnisse liefern. Becskeis Team hat nun eine neue Methode gefunden, mit der er zeigen konnte, dass RNA-Moleküle im Schnitt nicht 20 Minuten überdauern, sondern lediglich zwei Minuten leben. «Das war eine herausfordernde Aufgabe für uns, denn niemand wusste im Voraus, welche Methode die richtigen Ergebnisse liefern würde», sagt Becskei.
Die «Gene Control Methode» zeigt: RNAs leben kurz
Die Halbwertszeit einer RNA ist für wissenschaftliche Untersuchungen zum Zellzyklus relevant. Der gesamte Prozess der Zellteilung ist darauf angewiesen, dass die richtige Menge an Proteinen zum richtigen Zeitpunkt vorliegen. Stimmen die Konzentrationen in gewissen Phasen des Zellzyklus nicht, kommt es zu Fehlern.
Die von Becskei verwendete Genkontrollmethode ist bereits bekannt, wird bislang jedoch nicht zur Messung der Halbwertszeit von RNA-Molekülen eingesetzt. Grund dafür ist, dass komplexe Gentechniken dafür notwendig sind und sie langwierig ist, da sich mit ihr lediglich nur eine RNA zur selben Zeit untersuchen lässt. Dabei reguliert man ein einzelnes Gen auf der DNA so, dass die Herstellung der RNA an- und abgeschaltet werden kann. Unterbindet man die RNA-Produktion, lässt sich messen, wie lange die bereits produzierten RNAs in der Zelle überdauern. So lässt sich die Lebenszeit für dieses RNA-Molekül ermitteln. „Die Methode liefert also immer nur das Ergebnis für eine RNA, dafür ist das Ergebnis verlässlich“, so Becskei.
Die Versuche wurden für rund 50 verschiedene Gene wiederholt und zeigten, dass 80 Prozent aller RNAs eine kurze Lebensdauer haben und weniger als 2 Minuten leben. Nur rund 20 Prozent leben länger, etwa 5 bis 10 Minuten. «Diese Ergebnisse sind erstaunlich, wenn man bedenkt, dass man bislang davon ausging, dass RNAs durchschnittlich 20 Minuten in der Zelle überdauern», so Becskei.
Herkömmliche Methoden mit Haken
Bislang gab es im Wesentlichen zwei Hauptmethoden, derer sich Wissenschaftler bedienten, um die Halbwertszeit von RNA-Molekülen zu messen. Bei der transkriptionellen Inhibition wird der Zelle eine Substanz verabreicht, die die Herstellung der RNAs durch alle Gene stoppt. «Unterbindet man jedoch die Produktion aller RNAs, so ändern sich auch andere Prozesse in der Zelle und sie stellt ihre Funktion ein. Das verfälscht die Ergebnisse“, so Becskei.
Auch die In Vivo Markierung hat ihre Schattenseite: Hier werden die RNAs zunächst markiert und beobachtet, wie lange diese in der Zelle überdauern. Doch das Markieren mit modifizierten Molekülen kann die Funktion der Zelle stören und zu falschen Ergebnissen führen. Somit haben alle bisher verwendeten Methoden einen Nachteil, da die Messung selbst die zu messenden Prozesse beeinflusst. „Manchmal ist kaum zu glauben, dass Wissenschaftler rund 30 Jahre unwissentlich mit Methoden arbeiten, die verzerrte Ergebnisse liefern“, so Becskei. "Es scheint, dass der Philosoph und Wissenschaftstheoretiker Paul Feyerabend richtiglag: Wissenschaft ist oft ziemlich anarchistisch."
Die höchste Korrelation stellte das Forscherteam zwischen Becskeis Methode und einer Variante der «In-vivo Labelling» Methode fest. In den meisten Fällen klassifizierten beide Massnahmen dieselben RNAs als stabil und instabil, auch wenn sich die mittleren Halbwertszeiten unterscheiden. Nun möchte das Team untersuchen, in welchen Bereichen letztere die richtigen Ergebnisse liefert und sich verlässlich einsetzen lässt.
Originalveröffentlichung
Antoine Baudrimont, Sylvia Voegeli, Eduardo Calero Viloria,Fabian Stritt, Marine Lenon, Takeo Wada, Vincent Jaquet, Attila Becskei; "Multiplexed gene control reveals rapid mRNA turnover. Advanced Science"; published online July 12, 2017.