Deutschland erneut weltweit Nr. 2 bei klinischen Studien von Pharma-Unternehmen
Deutschland konnte 2016 erneut seine Position als weltweite Nr. 2 bei klinischen Arzneimittel-Studien von Pharma-Unternehmen behaupten. Das geht aus einer Auswertung des öffentlichen Studienregisters "clinicaltrials.gov" durch den Verband der forschenden Pharma-Unternehmen (vfa) hervor. Mit einer Beteiligung an 532 Studien, die 2016 begonnen wurden, liegt Deutschland vor UK (499), Kanada (463), Spanien (384) und Frankreich (336) und wird nur übertroffen von den USA (2.306) (Stand der Erhebung: 1. Juni 2016).
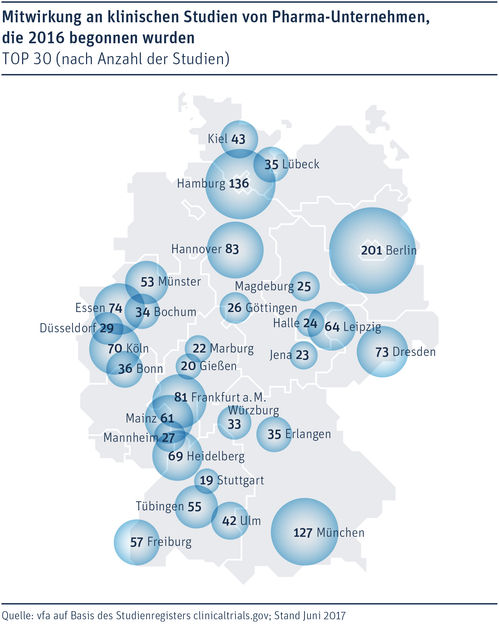
Mitwirkung an klinischen Studien von Pharma-Unternehmen, die 2016 begonnen wurden.
© vfa
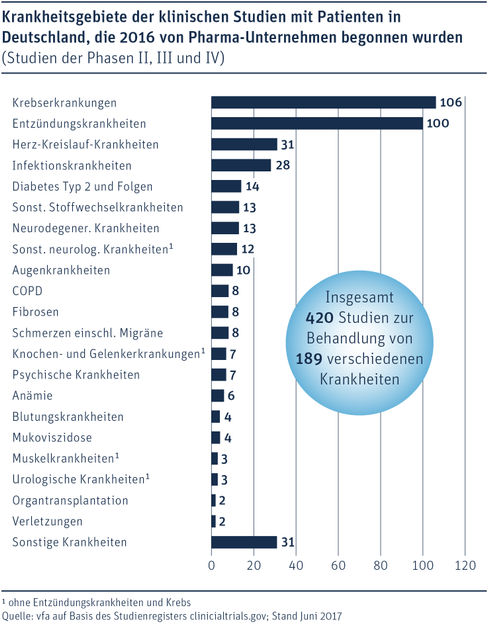
Krankheitsgebiete der klinischen Studien mit Patienten in Deutschland, die 2016 von Pharma-Unternehmen begonnen wurden.
© vfa
112 der 532 Studien dienten der ersten Erprobung von neuen Medikamenten mit Studienteilnehmern noch vor der Wirksamkeitsprüfung (in der sogenannten Phase I der klinischen Testreihe, die jedes Medikament durchlaufen muss). Mit den übrigen 420 Studien wurde die Wirksamkeit und Verträglichkeit von Medikamenten mit Patienten geprüft, die an 189 unterschiedlichen Krankheiten litten (Studien der Phasen II, III und IV).
Berliner medizinische Einrichtungen waren Spitzenreiter: Sie beteiligten sich an 201 Studien. Es folgten Hamburg (136), München (127), Hannover (83), Frankfurt a.M. (81), Essen (74), Dresden (73), Köln (70), Heidelberg (69) und Leipzig (69).
Dazu sagt Birgit Fischer, die Hauptgeschäftsführerin des Verbands der forschenden Pharma-Unternehmen (vfa): "Die Erprobung neuer Medikamente in Studien mit daran interessierten Patienten ist nur möglich, weil Unternehmen eng mit Ärzten in Krankenhäusern und Arztpraxen zusammenarbeiten können. Denn nur Ärzte dürfen Patienten behandeln. Damit diese Zusammenarbeit nachvollziehbar wird, setzen die forschenden Pharma-Unternehmen auf Transparenz, auch über die mit der Zusammenarbeit verbundenen Zahlungen. Diese werden sie bis Ende Juni wieder für das vergangene Jahr veröffentlichen. Damit bleiben die forschenden Pharma-Unternehmen beim Thema Transparenz Vorreiter in der Wirtschaft und im Gesundheitssystem."
Fischer weiter: "Pharma-Unternehmen leisten mit klinischen Studien einen wesentlichen Beitrag zur Förderung medizinischer Innovationen in der Gesundheitsversorgung. Die starke Stellung Deutschlands ist mit dem zweiten Platz weltweit bei Industrie-initiierten klinischen Studien eine ausgezeichnete Grundlage für Forschung und Patientenversorgung."
Schwerpunkte der Studientätigkeit in Deutschland
Im Regelfall führen Unternehmen Studien nicht nur in einem Land durch. Vielmehr kooperieren sie im Rahmen der gleichen Studie mit Kliniken und Arztpraxen in vielen Ländern zugleich; gerade für die großen letzten Studien vor der Zulassung (die Phase-III-Studien) können es bis zu 55 Länder sein. 40 % der Industrie-initiierten Studien, an denen sich deutsche Kliniken und Praxen 2016 beteiligt haben, waren solche Phase-III-Studien.
In den meisten der 420 Studien mit Patienten in Deutschland (Phase II, III, IV) ging es um die Erprobung neuer Therapien gegen Krebserkrankungen (106; 25 %) oder Entzündungskrankheiten (100; 24 %). Darauf folgten Studien zu Herz-Kreislauf-Krankheiten (31 Studien; 7 %) und Infektionskrankheiten (28; 7 %). Insgesamt wurden Studien zu 189 verschiedenen Krankheiten durchgeführt.
Zu den Entzündungskrankheiten (auch Autoimmunkrankheiten genannt) werden unter anderem Rheumatoide Arthritis, Asthma, Multiple Sklerose, Morbus Crohn, Colitis Ulcerosa, Schuppenflechte und Lupus gezählt. Sie alle gehen auf Fehlsteuerungen im Immunsystem zurück. Bei der Therapieentwicklung gegen Entzündungskrankheiten zeigt Deutschland besondere Stärke, denn entsprechende Studien haben hierzulande mit 24 % einen weit höheren Anteil am Studiengeschehen als in den anderen fünf studienstärksten Ländern: Es folgen Kanada (20 %), UK (18 %); Spanien (16 %), Frankreich und die USA (jeweils 13 %).
Dies korrespondiert mit der starken internationalen Stellung der deutschen Immunsystem-Forschung, der viele bahnbrechende Erkenntnisse zur menschlichen Immunabwehr zu verdanken sind.
Wert klinischer Studien für Deutschland
Der Wert klinischer Studien besteht nicht nur darin, zur Entwicklung neuer Therapien beizutragen. Für viele Teilnehmer, denen die bisher verfügbaren Therapien nicht helfen konnten, bedeuten sie eine Chance, mit einem neuen Medikament behandelt zu werden. Alle Teilnehmer werden vor, während und nach der Studie in aller Regel noch umfassender untersucht und intensiver betreut, als das in der Routineversorgung möglich ist - unabhängig davon, ob sie zu den Patienten gehören, die die neue Therapie oder eine Vergleichstherapie nach derzeitigem medizinischem Stand erhalten.
Eine Studienteilnahme ist stets freiwillig und erfolgt erst nach umfassender Aufklärung über die Studie (und die Behandlungsmöglichkeiten außerhalb der Studie) sowie nach schriftlichem Einverständnis, das der Teilnehmer auch jederzeit widerrufen kann.


























































