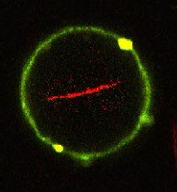
Wie Proteine Zellmembranen verformen
Zellen schnüren regelmäßig kleine Bläschen von ihrer Außenhaut ab und nehmen sie in ihr Inneres auf. Daran sind die EHD-Proteine beteiligt, die Professor Oliver Daumke vom MDC erforscht. Er und sein Team haben nun aufgeklärt, wie sich diese Proteine auf der Oberfläche von Zellen zusammenlagern und dadurch deren Außenhaut verformen.
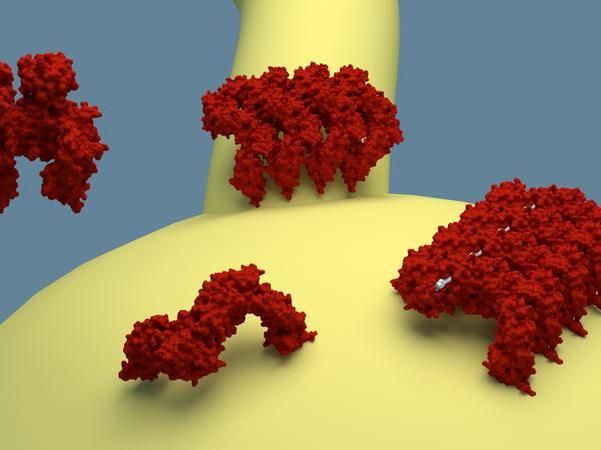
EHD-Proteine binden an Membranenoberflächen. In der Zelle liegen EHDs in einem gehemmten Zustand vor, Binden sie an die Membran, wechseln sie in einen aktiven Zustand.
Artur Alves de Melo, MDC
Auf dem Jahrmarkt zaubern Künstler mit ein paar Handgriffen aus einfachen Ballons kunstvolle Figuren. Dafür verformen sie die Ballonhaut und schnüren Teile davon ab. Auf ähnliche Art erzeugen Zellen in ihrer Außenhaut (Zellmembran) kleine Bläschen (Vesikel), die sie in ihr Inneres transportieren. Vesikel dienen zur Aufnahme von Nährstoffen und sind wichtig für die Weiterleitung von Nervensignalen.
EHD-Proteine sind an der Bildung solcher Vesikel beteiligt. Sie binden von innen an die Zellmembran und bilden dort lange Ketten und Ringe. Diese Ringe stülpen die Membran ein, ziehen sie zusammen und trennen sie letztlich von der Außenhaut der Zelle ab.
Oliver Daumke vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) erforscht die räumliche Struktur und die Funktionsweise der EHD-Proteine. In einer früheren Studie analysierten er und sein Team bereits die 3D-Struktur einer inaktiven EHD-Form, die nicht an die Membran gebunden ist. Wie EHD-Proteine aktiviert werden, um an Membranen zu binden und diese zu röhrenförmigen Gebilden zu verformen, war bisher nicht bekannt.
Die aktive Form der molekularen EHD-Maschine, wie sie im Kontakt mit der Membran vorkommt, beschreiben Daumke und sein Doktorand Arthur Alves de Melo zusammen mit internationalen Kollegen in der aktuellen Ausgabe der Fachzeitschrift PNAS. Der Vergleich der aktiven mit der inaktiven Proteinstruktur ergab, dass die EHD-Moleküle beim Binden an die Membran aufklappen. Dabei legen sie Regionen frei, die die es ihnen erlauben, sich zu ausgedehnten Ketten und Ringen zusammenzulagern. Ein weiterer spezialisierter Bereich dreht sich dabei so, dass er direkt mit der Membran Kontakt aufnehmen kann und die Proteine dort verankert.
Damit hat Daumkes Team zwei Schritte in der Arbeitsweise von EHD beschrieben. „Um den kompletten Arbeitszyklus und damit die Funktionsweise der molekularen EHD-Maschinen zu verstehen, müssen wir noch verschiedene andere Zustände analysieren“, sagt er. „Das ist eine Aufgabe für die nächsten Jahre.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.