Tarnkappen-Technologie für leuchtende Nanopartikel
Einem Forscherteam des Helmholtz-Zentrums Dresden-Rossendorf (HZDR) ist es in Kooperation mit Wissenschaftlern der australischen Monash University gelungen, die Stabilität und Biokompatibilität spezieller Nanopartikel erheblich zu steigern. Das Team hat sogenannte Upconverting Nanoparticles – „aufwärtskonvertierende“ Partikel, die Infrarotstrahlung in kurzwelliges Licht umwandeln – so modifiziert, dass sie wasserlöslich werden, selbst in komplexen Körperflüssigkeiten wie Blutserum stabil bleiben und Medikamente speichern können. Damit haben sie ein Werkzeug geschaffen, das den Kampf gegen Krebs deutlich effektiver machen könnte.
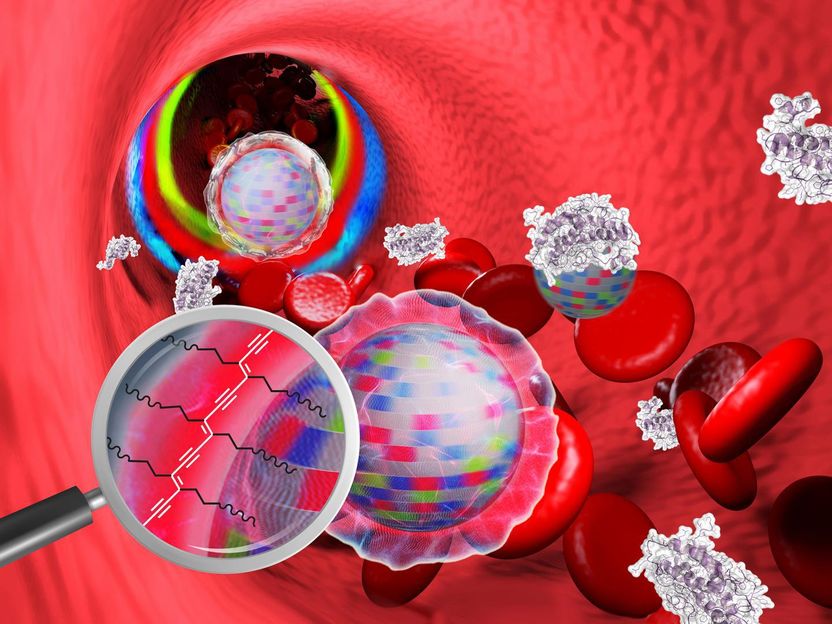
Nanopartikel im Blut: Die Tarnkappe verhindert das Anhaften von Blutbestandteilen. Die Oberfläche ist durch UV-Strahlung vernetzt (vergrößerter Bildausschnitt) und ist somit in biologischen Systemen stabil.
HZDR/Sahneweiss/istockphoto.com/Thomas-Soellner/Molekuul
Nanopartikel sind winzige Strukturen, die etwa 1 bis 100 Nanometer groß und damit rund 1000 bis 100.000 Mal kleiner sind als ein menschliches Haar im Querschnitt misst. Die Biomedizin nimmt diese Materialien zunehmend in den Fokus: Mit entsprechenden Eigenschaften ausgestattet, könnten sie in der Blutbahn fast jedes Gewebe im menschlichen Körper erreichen – die perfekten Körper-Sonden.
Seit einigen Jahren ist bekannt, dass die Verteilung der Nanopartikel im Körper wesentlich durch deren Größe und Oberflächeneigenschaften bestimmt wird. Letztere hat sich Dr. Tanmaya Joshi am Institut für Radiopharmazeutische Krebsforschung des HZDR bei den „Upconvertern“ genauer angeschaut: „Diese Nanopartikel sind sehr interessant für die biomedizinische Bildgebung“, erläutert der Chemiker. „Sie lassen sich mit Infrarotstrahlung anregen und senden dann intensives blaues, grünes oder rotes Licht aus. Falls es uns gelingt, derartige Nano-Sonden zielgerichtet zu erkrankten Geweben zu navigieren, ist das besonders für die Krebsdiagnose von großer Bedeutung“, fügt der Photochemiker des Teams, Dr. Massimo Sgarzi, hinzu.
Allerdings sind diese Lichtwandler-Partikel nur schlecht oder gar nicht in Wasser löslich – und damit auch nicht in Gewebeflüssigkeiten. Auch ansonsten lassen ihre Eigenschaften zu wünschen übrig, sodass an eine diagnostische oder therapeutische Verwendung bislang nicht zu denken war. Für das Team war dieses Hindernis ein Ansporn: „Mit einer speziellen Mischung von Polymeren ist es uns gelungen, die Partikel komplett zu ummanteln“, sagt Joshi, der 2017 von der Monash University als Humboldt-Stipendiat an das HZDR kam. Die Schutzhülle macht die Lichtwandler-Nanopartikel biokompatibel: „Die Upconverter werden dadurch wasserlöslich, und sie besitzen eine neutrale Oberflächenladung. Unsere Untersuchungen haben ergeben, dass sie kaum an körpereigene Substanzen in Blutserum binden. Mit anderen Worten: Die Nanopartikel scheinen unter einer Tarnkappe zu stecken. Wir gehen davon aus, dass sie dadurch auch nicht von den Fresszellen des Immunsystems erkannt und eliminiert werden“, beschreibt Biologe Dr. Kristof Zarschler.
Um die neuen Nano-Sonden auch in einer komplexen biologischen Umgebung wochenlang stabil zu halten, vernetzen die Wissenschaftler die Komponenten der Schutzhülle photochemisch miteinander: „Wir haben unsere Nanopartikel ganz einfach mit UV-Licht bestrahlt. Dadurch bilden sich zusätzliche Bindungen zwischen den Bausteinen der Hülle aus – wir haben sozusagen die Einzelteile der Tarnkappe mithilfe von Licht miteinander vernäht“, erklärt Doktorandin Anne Nsubuga: „Unter dieser Hülle, die nur wenige Nanometer dünn ist, kann man womöglich sogar weitere Substanzen verstecken, Krebsmedikamente beispielsweise. Sie könnten von den Nanopartikeln gezielt in einem Tumor freigesetzt werden und ihn dann zerstören.“
In einem nächsten Schritt will das Team herausfinden, ob sich ihre aktuellen Ergebnisse auch in lebenden Organismen bestätigen lassen: „Dazu müssen wir zunächst streng reglementierte und ethisch vertretbare Tierversuche durchführen. Wenn die Tarnkappen-Technologie auch dort funktioniert, widmen wir uns dem medizinischen Potenzial im Detail und fassen auch Anwendungen am Patienten ins Auge“, erläutert Gruppenleiter Dr. Holger Stephan.






















































