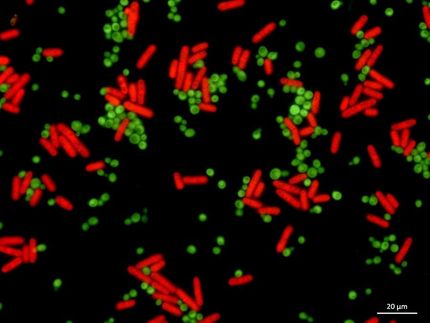
Solarmodule für Hefezellen-Biofabriken
Gentechnisch veränderte Mikroben wie Bakterien und Hefen werden seit langem als lebende Fabriken zur Herstellung von Medikamenten und Feinchemikalien eingesetzt. Seit kurzem kombinieren die Forscher Bakterien mit Halbleitertechnologie, die ähnlich wie Solarmodule auf dem Dach eines Hauses Energie aus Licht gewinnt und, wenn sie an die Oberfläche der Mikroben gekoppelt sind, ihr biosynthetisches Potenzial steigern kann.
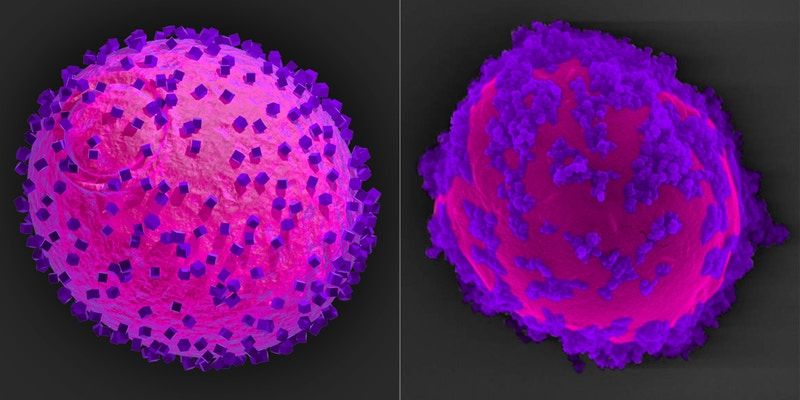
Das Modell einer Hefezelle (Magenta) mit Halbleiternanopartikeln (lila) an ihrer Oberfläche (links) entspricht ihrer REM-Analyse des fertigen Biohybridsystems (rechts). Die Halbleiter fangen Elektronen aus dem Licht ein und übergeben sie der Zelle, wo sie den Stoffwechselweg der Shikimisäure steuern.
Wyss Institute at Harvard University
Die ersten "biologisch-anorganischen Hybridsysteme" (Biohybride) konzentrierten sich hauptsächlich auf die Fixierung von atmosphärischem Kohlendioxid und die Produktion alternativer Energien, zeigten aber auch zentrale Herausforderungen auf. So werden beispielsweise Halbleiter, die aus giftigen Metallen bestehen, bisher direkt auf Bakterienzellen montiert und schädigen diese dabei oft. Darüber hinaus hat der anfängliche Fokus auf kohlenstofffixierende Mikroben die Produktpalette auf relativ einfache Moleküle beschränkt; wenn Biohybride auf der Grundlage von Mikroorganismen mit komplexeren Stoffwechselvorgängen hergestellt werden könnten, würde dies neue Wege für die Herstellung einer viel größeren Bandbreite von Chemikalien eröffnen, die für viele Anwendungen nützlich sind.
Ein multidisziplinäres Team unter der Leitung von Neel Joshi, Mitglied der Core-Faculty, und den Postdoktoranden Junling Guo und Miguel Suástegui vom Wyss Institute for Biologically Inspired Engineering in Harvard und der John A. Paulson School of Engineering and Applied Sciences (SEAS) bietet eine sehr flexible Lösung für diese Herausforderungen.
"Während unsere Strategie konzeptionell auf früheren bakteriellen Biohybridsystemen aufbaut, die von unserem Mitarbeiter Daniel Nocera und anderen entwickelt wurden, haben wir das Konzept auf Hefe erweitert - einen Organismus, der bereits ein industrielles Arbeitspferd ist und genetisch leicht zu manipulieren ist - mit einer modularen Halbleiterkomponente, die biochemische Energie für die Stoffwechselmaschinen der Hefe liefert, ohne toxisch zu sein", sagte Dr. Joshi. Co-Autor Nocera ist der Patterson Rockwood Professor für Energie an der Harvard University. Durch die kombinierten Manipulationen wurde die Fähigkeit der Hefen zur Produktion von Shikimisäure, einem wichtigen Vorläufer des antiviralen Medikaments Tamiflu, mehrerer anderer Medikamente, Nutraceuticals und Feinchemikalien, deutlich verbessert.
Die Bäckerhefe Saccharomyces cerevisiae produziert auf natürliche Weise Shikimisäure, um einige ihrer Bausteine für die Synthese von Proteinen und anderen Biomolekülen zu erzeugen. Durch die genetische Veränderung des zentralen Stoffwechsels der Hefe ermöglichten die Forscher den Zellen jedoch, mehr der Kohlenstoffatome, die ihre Hauptnährstoffquelle, die Zuckerglukose, enthält, in den Weg zu leiten, der Shikimisäure produziert, und den Verlust von Kohlenstoff an alternative Wege zu verhindern, indem sie einen von ihnen unterbrechen.
"Im Prinzip sollte der erhöhte Kohlenstofffluss in Richtung Shikimisäure zu höheren Produktniveaus führen, aber in normalen Hefezellen liefert der alternative Weg, den wir zur Ertragssteigerung unterbrochen haben, vor allem auch die Energie, die benötigt wird, um den letzten Schritt der Shikimisäureproduktion voranzutreiben", sagte Mitautor Miguel Suástegui, Ph.D., ein Chemieingenieur und ehemaliger Postdoc in Joshi's Team und jetzt Scientist bei Joyn Bio LLC. Um den kohlenstoffwirksameren, aber energieverschwenderischeren Weg der Shikimisäure zu fördern, "haben wir angenommen, dass wir das entsprechende energietragende Molekül NADPH stattdessen in einem biohybriden Ansatz mit lichtempfindlichen Halbleitern erzeugen könnten".
Zu diesem Zweck arbeitete Suástegui mit Junling Guo, Ph.D., dem anderen Co-Autor und Mitautor der Studie, zusammen er ist derzeit Postdoktorand mit Erfahrung in Chemie und Materialwissenschaften in Joshis Labor. Sie entwickelten eine Strategie, die Indiumphosphid als Halbleitermaterial verwendet. "Um die Halbleiterkomponente wirklich modular und ungiftig zu machen, haben wir Indiumphosphid-Nanopartikel mit einem natürlichen "Klebstoff" auf Polyphenolbasis beschichtet, der es uns ermöglichte, sie an die Oberfläche von Hefezellen zu binden und gleichzeitig die Zellen von der Toxizität des Metalls zu isolieren", sagt Guo.
An die Zelloberfläche gebunden und beleuchtet, gewinnen die Halbleiternanopartikel Elektronen (Energie) aus dem Licht und übergeben sie den Hefezellen, die sie über ihre Zellwände in ihr Zytoplasma leiten. Dort erhöhen die Elektronen das Niveau der NADPH-Moleküle, die nun die Biosynthese von Shikimisäure antreiben können. "Die Hefebiohybridzellen produzierten im Dunkeln meist einfachere organische Moleküle wie Glycerin und Ethanol; aber wenn sie dem Licht ausgesetzt waren, wechselten sie leicht in den Produktionsmodus der Shikimisäure mit einer 11-fachen Erhöhung des Produktniveaus, was uns zeigt, dass der Energietransfer vom Licht in die Zelle sehr effizient funktioniert", sagt Joshi.
"Dieser skalierbare Ansatz schafft einen völlig neuen Gestaltungsraum für zukünftige Biohybridtechnologien. In Zukunft können die Art der Halbleiter und die Art der gentechnisch veränderten Hefezellen Plug-and-Play variiert werden, um die Art der Herstellungsverfahren und die Bandbreite der Bioprodukte zu erweitern", sagte Gu.