Neuer Schalter entscheidet zwischen Reparatur und Zelltod
Anzeigen
Eine der wichtigsten Entscheidungen, die eine Zelle zu treffen hat, ist eine Frage von Leben und Tod: kann ein Schaden repariert werden oder ist es sinnvoller zellulären Selbstmord zu begehen um weitere Schädigung zu verhindern? In einer Kaskade eines bisher wenig verstandenen Signalweges konnten Forscher des Exzellenzclusters für Alternsforschung CECAD an der Universität zu Köln ein Protein identifizieren (UFD-2), das eine Schlüsselrolle in dem Prozess einnimmt.
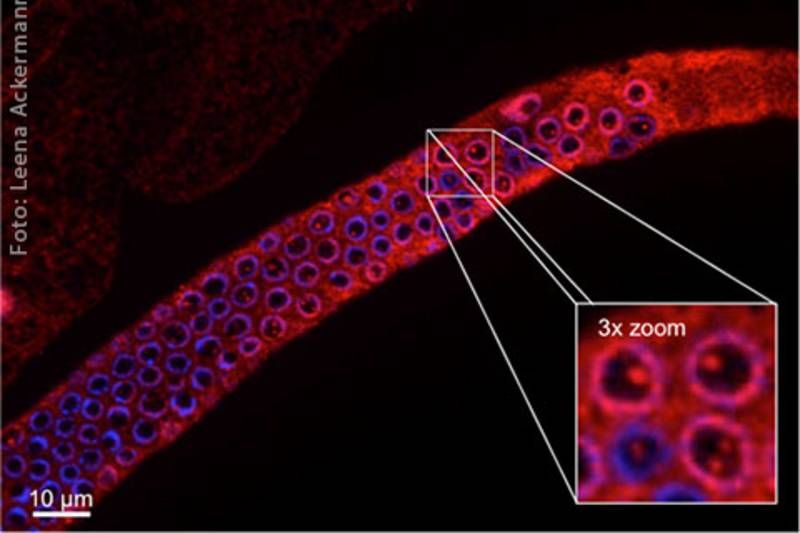
Keimbahn von C. elegans. Schädigung der DNA induziert die Bildung großer UFD-2-Komplexe in C. elegans. Dort wird die Entscheidung zwischen Reparatur und Tod getroffen. Das Protein UFD-2 ist rot gefärbt, die DNA ist bläulich sichtbar.
Leena Ackermann
Die genetische Information einer jeden Zelle liegt in ihrer Sequenz der DNA-Doppelhelix. Doppelstrangbrüche der DNA, die durch Strahlung hervorgerufen werden können, sind eine gefährliche Bedrohung für die Zelle und können zu Krebs führen wenn sie nicht repariert werden. Beschädigte Zellen stehen daher vor der Entscheidung, ob die Brüche ausgebessert werden können oder entfernt werden müssen, um Krebs zu verhindern. Dies geschieht durch ein zelluläres „Selbstmord-Programm“, das Apoptose genannt wird.
Björn Schumacher, einer der Hauptautoren der Studie, erklärt: „Innerhalb von Sekunden nach der Schädigung setzen verschiedene Mechanismen ein. Auf eine schizophrene Art und Weise beginnen die Zellen sowohl die Reparatur als auch die Vorbereitung für die Apoptose. Wir identifizierten einen unbekannten Mechanismus, der die Signale sowohl der stattfindenden Reparatur als auch die der Zelltod-Maschinerie integriert. Ein Protein, UFD-2, bildet große Komplexe an den Brüchen und prüft, ob die Reparatur fortgesetzt wird oder es für die Zelle Zeit ist zu sterben.“ In diesem Prozess ist UFD-2 ein Knotenpunkt, der Signale empfängt und gibt.
Die Experimente wurden an dem Fadenwurm Caenorhabditis elegans durchgeführt. „Für unsere Forschung untersuchten wir unterschiedliche Stämme von C. elegans, sowohl vom Wildtyp als auch genetisch modifizierte. Sie wurden ionisierender Strahlung ausgesetzt und danach untersucht“, erklärt Leena Ackermann, Erstautorin der Studie. Schumacher ergänzt: „Die Ergebnisse sind wichtig um besser zu verstehen, warum und wie eine Zelle sich für Reparatur oder Tod entscheidet. Verläuft die Reparatur erfolgreich oder ist doch die Apoptose nötig? Zellen, denen UFD-2 fehlt, können keine Apoptose durchführen. Bei Menschen kann das das Risiko erhöhen, dass sich eine beschädigte Zelle zu Krebs entwickelt.“
Alle Proteine, die eine Rolle bei diesem Mechanismus spielen, finden sich auch in Menschen. Die Erkenntnisse sind von hoher Relevanz um zu verstehen, wie DNA-Schäden zu Krebs führen. Außerdem sind DNA-Schäden ein wichtiger Faktor im Alterungsprozess. Auch wenn Apoptose vor Krebs schützt, kann exzessive Apoptose zu Gewebeabbau und Alterung führen. Thorsten Hoppe, ebenfalls Hauptautor der Studie, identifizierte UFD-2 bereits als Regulator für den Abbau von Proteinen. Hier bildet UFD-2 Regulationszentren, die die Reparatur der DNA und den Zelltod koordinieren. Thorsten Hoppe hofft auf weitere Fortschritte in der Tumortherapie: „Das Wissen aus dieser Studie bietet neue Perspektiven, wie man Krebs pharmazeutisch bekämpfen kann. Es könnte möglich sein, den ausgewogenen Prozess von Proteinabbau und Apoptose zu manipulieren und damit die Entfernung von Tumorzellen effektiver zu machen.“