Keine Blutgefäße ohne Cloche
Nach 20 Jahren des Suchens entdecken Forscher das geheimnisvolle Gen, das die Entstehung von Gefäßen und Blutzellen kontrolliert
Dass Wissenschaft spannend sein kann, zeigt die jahrzehntelange Jagd von Forschern auf der ganzen Welt nach einem Gen, das die Entstehung von Blut und Gefäßen im Embryo entscheidend steuert. Vor mehr als 20 Jahren isolierte Didier Stainier vom Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim eine Zebrafisch-Mutante namens Cloche, in deren Embryonen sich weder Blutgefäße noch Blutzellen entwickelten, ein bis heute einzigartiges Phänomen. Jetzt hat seine Arbeitsgruppe jenes Gen gefunden, das dafür verantwortlich ist. Es hatte sich am äußersten Ende des Chromosoms 13 gewissermaßen versteckt und war erst durch den Einsatz neuester molekularbiologischer Methoden aufzuspüren. Die Entschlüsselung des Gens dürfte nicht nur von wissenschaftlichem Interesse sein, sondern könnte auch für die regenerative Stammzellmedizin wichtig werden.
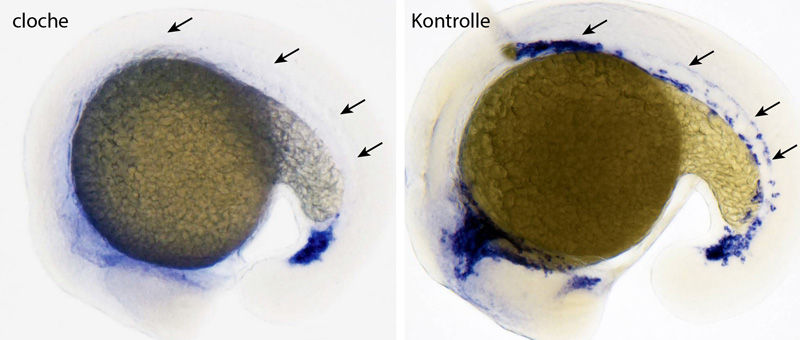
Während nach rund 16 Stunden im Kontrollembryo erstmals Blutgefäßzellen (blau, Pfeile) nachgewiesen werden können, entstehen in der Cloche-Mutante weder Gefäß- noch Blutzellen (Pfeile).
MPI f. Herz- und Lungenforschung
Bereits in einer sehr frühen Phase der Embryonalentwicklung bilden sich Blutgefäße und Blutzellen aus gemeinsamen Vorläuferzellen. Wann und wie sich Blut und Gefäße bilden, regulieren mehrere Gene in Form eines genetischen Programms. Dieses ist kaskadenartig aktiv.
Bereits Mitte der neunziger Jahre während seiner Zeit in den USA entdeckte Didier Stainier, Direktor der Abteilung Genetik der Entwicklung am Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim, beim Modellorganismus Zebrabärbling (Danio rerio) eine Mutante, „die einen der spannendsten Entwicklungsdefekte aufweist, die je im Zebrafisch gefunden wurden“, so Sven Reischauer, zusammen mit Oliver Stone und Alethia Villasenor Hauptautor der Studie. Eine genetische Veränderung in diesem Fisch führte dazu, dass sich in den Embryonen keines der am Programm für Blut- und Gefäßzellen beteiligten Gene einschaltet. Entsprechend können diese Zelltypen nicht entstehen. Stainier gab der Mutante nach dem glockenförmig deformierten Aussehen des Herzens, einer weiteren Eigenheit der Mutante, den Namen „Cloche“.
In den letzten beiden Jahrzehnten beteiligten sich verschiedene Labore weltweit an einer regelrechten Jagd nach dem Gen, das sich hinter der Mutante verbirgt. „Cloche zu identifizieren war für uns alle wie das Aufklären eines jahrzehntealten Kriminalfalls der Genetik. Allerdings war in diesem Fall nicht der Täter unbekannt, sondern das Opfer, das defekte Gen“, so Reischauer. Diese Jagd beendeten die Bad Nauheimer Max-Planck-Forscher nun zusammen mit internationalen Kooperationspartnern erfolgreich.
„Extrem erschwert wurde die Suche nach dem Cloche-Gen dadurch, dass es sich am äußersten Ende von Chromosom 13 versteckte, in den sogenannten Telomeren“, so Reischauer. Nur mit den erst seit kurzem zur Verfügung stehenden Methoden, beispielsweise CRISPR/Cas9 und TALEN, konnten die Forscher diese Abschnitte auf den Chromosomen überhaupt analysieren. „Außerdem mussten wir davon ausgehen, dass das Gen nur vor dem Zeitpunkt aktiv ist, an dem das fehlende Gefäßwachstum erkennbar wird. Dadurch war es wesentlich schwerer, die Embryonen zu identifizieren“, erläutert Reischauer.
Im ersten Schritt untersuchten die Bad Nauheimer Forscher zunächst den gesamten Abschnitt des Erbguts, in dem sie Cloche vermuteten. Die Analyse der Daten von 26.000 Genen ergab rund 17 Gene, die als Kandidaten in Frage kamen. Anschließend schalteten sie alle diese Kandidatengene gezielt einzeln ab und untersuchten das Blutgefäßwachstum in den Embryonen. „Nur in einem einzigen Fall fanden wir das erwartete Bild, nämlich dass das Gefäßwachstum ausblieb. Da konnten wir uns sicher sein, das Cloche-Gen gefunden zu haben“, sagt Reischauer.
Welche Bedeutung Cloche für die Entwicklung von Gefäßen und Blutzellen im Embryo besitzt, zeigten die Max-Planck-Wissenschaftler in weiteren Experimenten: So stellte sich heraus, dass alle bisher bekannten, an der Gefäßentstehung beteiligten Gene zeitlich erst nach Cloche aktiv werden. Cloche selbst steuert demnach die Aktivität des gesamten Programms.
Dies bestätigte sich in einem sogenannten Überexpressions-Experiment, bei dem die Forscher reine Cloche-mRNA in Embryonen injizierten. Dadurch konnten sie das Programm für die Gefäß- und Blutentstehung zu einem Zeitpunkt des Embryonalwachstums starten, an dem es normalerweise inaktiv ist. „Wir waren deshalb sicher, dass wir das Gen gefunden haben, das für die Kontrolle des Entwicklungsprogramms verantwortlich ist“, sagt Stainier.
Cloche scheint sich im Laufe der Evolution kaum verändert zu haben: Bis hin zu Vögeln ist das Gen vorhanden. Bei Säugern gibt es ein eng verwandtes Gen, das im Zebrafisch-Modell die Funktion von Cloche übernehmen kann. Deswegen vermuten die Bad Nauheimer Wissenschaftler, „dass sich mit der Identifizierung des Gens und seiner Funktion große Chancen ergeben, neue Anwendungen im Rahmen der personalisierten Stammzelltherapie entwickeln zu können“, so Stainier.