Cpf1: CRISPR-Enzymschere schneidet RNA und DNA
Wissenschaftler klären Wirkungsweise eines neuen CRISPR-Cpf1-Systems in Bakterien auf
Anzeigen
Wenige Jahre nach ihrer Entdeckung ist die Gen-Schere CRISPR-Cas9 aus der Genetik nicht mehr wegzudenken. Sie ist ein exaktes und vielfältig einsetzbares Werkzeug für die Veränderung von Erbgut unterschiedlicher Organismen. Seitdem arbeiten Forscher weltweit daran, das CRISPR-Cas9-System weiter zu verbessern und es für ihre Zwecke zu optimieren. Forscher des Berliner Max-Planck-Instituts für Infektionsbiologie, der Universität Umeå in Schweden und des Helmholtz-Zentrums für Infektionsforschung in Braunschweig haben nun entdeckt, dass das CRISPR-assoziierte Protein Cpf1 eine bislang für diese Enzymfamilie einzigartige Eigenschaft besitzt: Es schneidet sowohl RNA als auch DNA. Im Unterschied zu CRISPR-Cas9 kann Cpf1 das Vorläufermolekül der CRISPR-RNA, die sogenannte pre-crRNA, alleine in ein funktionstüchtiges crRNA-Molekül umwandeln. Die fertige crRNA zeigt Cpf1 dann, wo es die DNA schneiden muss. Das System benötigt also keine weiteren Faktoren und ist damit das einfachste bislang bekannte CRISPR-Immunsystem. Dieses duale Schneidewerkzeug für RNA und DNA könnte künftig möglicherweise auch eingesetzt werden, um im Erbgut mehrere Gene gleichzeitig zu verändern, auch „multiplexing“ genannt.
CRISPR-Cas ist Teil des Immunsystems von Bakterien, mit dem diese sich gegen Viren wehren. In diesem System schneidet das Enzym Cas9 die DNA der Viren an einer Stelle, die von zwei RNA-Molekülen vorgegeben wird – der sogenannten CRISPR RNA (crRNA) und der tracrRNA. Dadurch werden die Erreger außer Gefecht gesetzt.
2011 hat Emmanuelle Charpentier zusammen mit Kollegen entdeckt, dass CRISPR-Cas9 aus dem Enzym Cas9 und zwei RNA-Moleküle besteht, der pre-crRNA und der tracrRNA. Letztere wandelt das Vorläufermolekül in die reife crRNA um. Ein Jahr später demonstrierten die Wissenschaftler, dass Cas9 zu seinem Ziel auf dem DNA-Strang führen. Beide Moleküle lassen sich zudem zu einem einzigen fusionieren.
Seitdem hat CRISPR-Cas9 einen Siegeszug durch die Labore angetreten. Aber nicht nur Wissenschaftler, auch Mediziner hegen große Hoffnungen: Sie wollen die Gen-Schere dazu einsetzen, schwere Erbkrankheiten zu heilen.
„So einfach sich die Wirkungsweise von CRISPR-Cas9 auch anhört, es gibt jedoch einige Feinheiten“, sagt Charpentier, inzwischen Direktorin am Max-Planck-Institut für Infektionsbiologie. Denn bevor die crRNA dem Cas9-Protein den Schnittpunkt auf der DNA zeigen kann, muss sie selbst in ihre endgültige Form gebracht werden: RNA-schneidende Proteine sind notwendig, damit eine ausgereifte und funktionsfähige crRNA entsteht. Eines davon ist die RNase III. Charpentier fand 2011 heraus, dass dieses Enzym zusammen mit der tracrRNA am Reifungsprozess der crRNA beteiligt ist.
Minimalistisches CRISPR-System
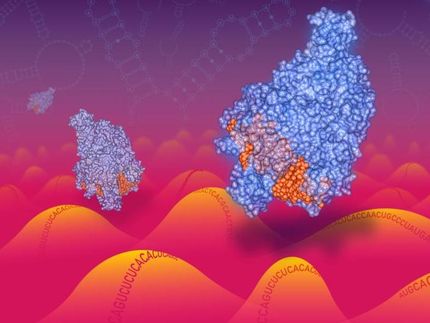
Nun haben die Forscher entdeckt, dass der Abwehrmechanismus mancher Bakterien noch einfacher aufgebaut ist als CRISPR-Cas9. Diese besitzen zusätzlich zu Cas9 das Enzym Cpf1 zum Durchtrennen von Fremd-DNA. Die Untersuchungen zeigen nun, dass Cpf1 sowohl RNA als auch DNA schneiden kann. Cpf1 entfernt zunächst einzelne Abschnitte des crRNA-Moleküls und fungiert so als Reife-Protein. Zusätzliche Proteine wie RNase III sind nicht erforderlich. Die fertige crRNA leitet Cpf1 dann zu seinem Zielabschnitt auf der DNA.
Cpf1 hat folglich eine Doppelfunktion: Zunächst macht es die crRNA funktionstüchtig. Dann durchtrennt es die DNA an dem von der crRNA bestimmten Abschnitt. Cpf1 ist darüber hinaus im Gegensatz zu Cas9 nicht auf die Hilfe einer tracrRNA angewiesen, um zu seinem Zielort zu gelangen.
Das System ist damit noch einfacher aufgebaut als CRISPR-Cas9. „CRISPR-Cpf1 funktioniert wie ein „plug and play“-System ohne zusätzliche Komponenten. CRISPR-Cas9 dagegen braucht in seiner natürlichen Umgebung noch einen Assistenten, der das System aktiviert“, erklärt Charpentier.
„Es ist noch nicht klar, ob CRISPR-Cpf1 gegenüber CRISPR-Cas9 Vorteile als Werkzeug für die Gen-Editierung besitzt. Dass die Evolution ein so minimalistisches und trotzdem effektives Abwehrsystem gegen Viren hervorgebracht hat, hat uns aber sehr überrascht“, sagt Charpentier. „Möglicherweise besitzen Bakterien noch weitere – die Suche nach ihnen ist bereits in vollem Gange.“