Zelluläre "Licht-Schalter" mit Neutronenstreuung analysiert
Anzeigen
Die inneren Bewegungen von Proteinen können für ihre Funktionsfähigkeit bedeutend sein. Dafür finden Forscher immer mehr Beispiele. Auch bei den in der Natur weit verbreiteten und zudem biotechnologisch bedeutsamen "LOV-Photorezeptoren" haben Wissenschaftler aus Jülich, Aachen, Düsseldorf und Garching bei München nun mit Hilfe von Neutronenspektroskopie dynamische Prozesse nachgewiesen. Die Ergebnisse zeigen das große Potential von Neutronenstreuuntersuchungen für die Untersuchung zellulärer Prozesse.
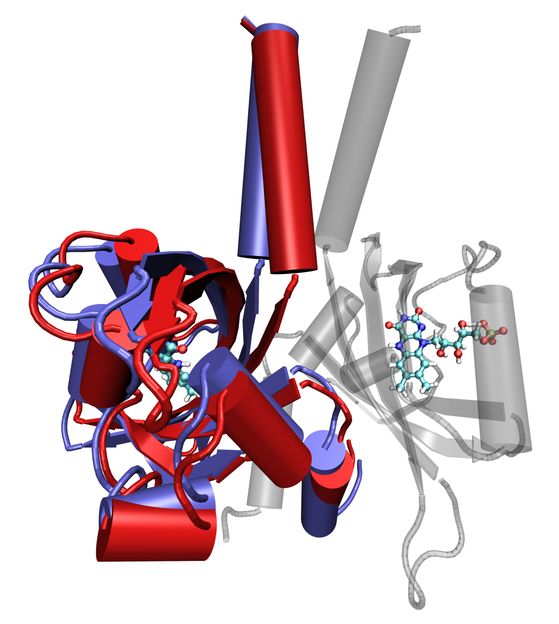
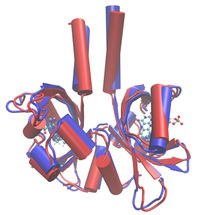
Überlagerte Bewegungsstadien eines LOV-Proteins (im Vordergrund), erstellt mit Molekulardynamiksimulation. Die rot eingefärbten Bereiche zeigen die Ausgangsstellung, die blau eingefärbten die Endstellung. Eine funktionsfähige Einheit besteht aus zwei LOV-Domänen – die zweite ist semitransparent im Hintergrund zu sehen. Die lichtabsorbierenden Zentren des Proteins sind in beiden Untereinheiten als Kugel-Stab-Modelle dargestellt.
Copyright: Forschungszentrum Jülich/M. Bocola, RWTH Aachen
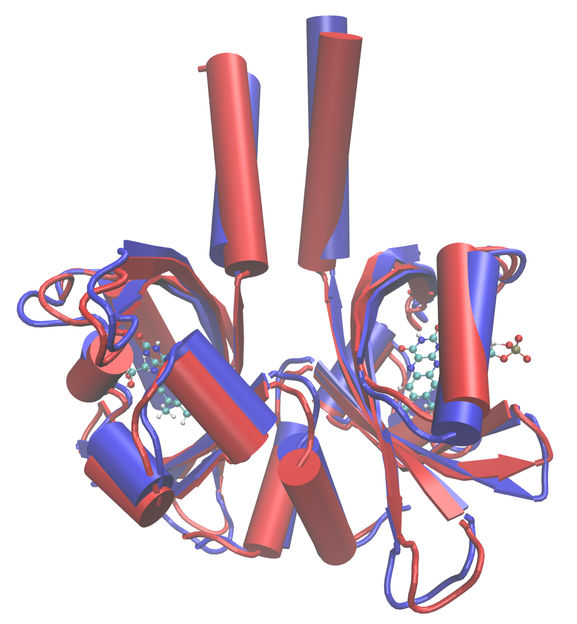
Die Form einer Funktionseinheit aus zwei LOV-Proteinen erinnert an einen Hasenkopf.
Copyright: Forschungszentrum Jülich/M. Bocola, RWTH Aachen
Molekularbiologen lieben LOV-Proteine, denn mit ihrer Hilfe lassen sich biologische Vorgänge fast wie mit einem Schalter an- und ausknipsen. Wenn man sie mit anderen Proteinen koppelt, lassen sich diese mit Licht steuern und Stoffwechselprozesse in den modifizierten Zellen untersuchen. Der emotional klingende Name der biologischen Schalter hat einen nüchternen Ursprung: Es handelt sich um ein Akronym der englischen Begriffe für Licht, Sauerstoff und Spannung – der ausgeschriebene Name lautet "Flavin-binding light, oxygen, voltage photoreceptor".
In der Natur stimulieren solche lichtsensitiven Eiweißmoleküle zum Beispiel das Wachstum von Pflanzen zum Licht und in Bakterien die Bildung von Photosynthesepigmenten, wenn Licht auf sie fällt. Ihre große Verbreitung und ihr technologischer Nutzen rühren unter anderem daher, dass sie modular funktionieren: Die Schaltfunktion lässt sich mit verschiedenen Prozessen kombinieren.
Die ersten Untersuchungen von LOV-Proteinen mit Hilfe von Neutronenstreuung am Heinz Maier-Leibnitz Zentrum in Garching zeigten nun die Bedeutung der Bewegungen im Inneren der Biomoleküle für ihre Funktionsfähigkeit. Die Forscher analysierten dazu Rezeptoren aus dem Bodenbakterium Pseudomonas putida mit einer zeitlichen Auflösung im Nano- und Pikosekundenbereich. "Im unbelichteten Protein fanden wir stärkere Bewegungen als im belichteten", erläutert Dr. Andreas Stadler vom Institute of Complex Systems und Jülich Centre for Neutron Science am Forschungszentrum Jülich. "Die belichtete Version ist steifer, vor allem in bestimmten Bereichen."
Um herauszufinden, welche Bereiche des Proteins sich bewegen, verglichen die Forscher ihre Neutronenanalysen mit bereits aus Röntgenuntersuchungen bekannten Strukturinformationen von kristallisierten LOV-Proteinen und simulierten zudem potentielle Bewegungen am Computer. Denn Neutronen können nicht direkt die Bewegungen eines einzelnen Proteinmoleküls erfassen, sondern nur die gemittelten Bewegungen aller Proteine in der Probe. Deshalb sind stets weitere Untersuchungen nötig, um die Ergebnisse richtig interpretieren zu können. "Dann spielen die Neutronen ihre Fähigkeiten wie in diesem Fall optimal aus und können einzigartige Einblicke in die Funktion von biologischen Prozessen liefern", freut sich Stadler.
Bekannt war bereits, dass im Fall des untersuchten LOV-Proteins jeweils zwei Proteinmoleküle zusammen eine Funktionseinheit bilden. Deren Form erinnert in ihrer aktiven, belichteten Form an einen Hasenkopf mit spitz aufgestellten Ohren. In der nichtaktiven, unbelichteten Form hängen die „Ohren“. Die Bewegungen, die die Forscher nun bei den unbelichteten Proteinen gefunden haben, passen genau zu der Vorstellung, dass dieser Zustand flexibler und beweglicher ist, wohingegen die stehenden "Ohren" unbeweglicher, steifer sind.
Aus früheren Untersuchungen war ebenfalls bekannt, dass das lichtaktive Zentrum sich jeweils im "Backenbereich" der Hasenkopfform des Proteins befindet. Bei Belichtung entsteht eine chemische Bindung zwischen dem lichtaktiven Zentrum und einer bestimmten Stelle des Proteinrückrats. Die Forscher gehen nun davon aus, dass die Bildung dieser Bindung zu strukturellen Änderungen führt, die sich durch das Protein bis zu den "Ohren" fortpflanzen und deren Versteifung und gleichzeitige Verdrehung auslöst. Die "Ohren" stellen vermutlich den eigentlichen Schalter dar, der daran gekoppelte Proteine aktivieren und deaktivieren kann.
Für die Untersuchung von Proteinen bieten Neutronen viele Vorteile gegenüber anderen Methoden und können komplementäre Informationen liefern. So müssen die Proteine weder gefärbt noch kristallisiert noch anderweitig verändert werden, um sie zu untersuchen. Auch ist das Verfahren sehr sanft zu den Proben, die dadurch länger beobachtet werden können. Und es kann leichte Atome in den Molekülen, unter anderem Wasserstoff, besser detektieren, auch in der natürlichen Umgebung von Proteinen – wässrigen Lösungen.