Neue Ansätze für die Sepsis-Therapie durch Evolution von Signalmolekülen
Proteinengineering erweitert Immunzellvokabular
Kleine Infektionen können tödlich enden: Millionen Menschen sterben jedes Jahr an einer Sepsis, einer überschießenden Reaktion des Immunsystems. Ein neues Signalmolekül, entworfen von einem Forschungsteam der Technischen Universität München (TUM), hat das Potential, als Basis neuer Sepsis-Therapien zu dienen.

Erstautorin Stephanie Müller und Prof. Feige im Labor für Zelluläre Proteinbiochemie.
A. Battenberg / TUM
Die Zahlen sind alarmierend: Nach Schätzungen der Weltgesundheitsorganisation WHO kommen jährlich sechs Millionen Menschen durch Sepsis ums Leben. Die im Volksmund „Blutvergiftung“ genannte Krankheit beginnt meist mit einer harmlosen Infektion.
Führt diese zu einer überschießenden Reaktion des Immunsystems, kann körpereigenes Gewebe angegriffen und geschädigt werden. Die Überreaktion führt schließlich zu einer lebensbedrohlichen Erschöpfung der körpereigenen Abwehr. Allein in Deutschland sterben mehr Menschen an Sepsis als an AIDS, Darm- und Brustkrebs zusammen.
Weltweit suchen Forscher nach geeigneten Therapien – bisher vergeblich. Einem interdisziplinären Team aus den Bereichen Strukturbiologie, Immunologie und Zellbiologie ist es jetzt erstmals gelungen, ein Protein herzustellen, das die Reaktion der Immunzellen bändigen kann.
Die Sprache der Botenstoffe
Bei ihrer Entwicklung wurden die Forscherinnen und Forscher inspiriert durch die Evolution. Mäuse beispielsweise sind durch ihr Immunsystem gut vor Sepsis geschützt. Eine Schlüsselrolle spielen dabei die Interleukine, Botenstoffe, welche die Kommunikation zwischen den Zellen des Immunsystems ermöglichen.
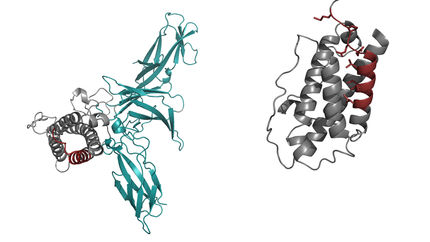
„Die Interleukine sind das Vokabular, mit dem Immunzellen kommunizieren“, erklärt Matthias Feige, Professor für Zelluläre Proteinbiochemie an der TU München. Die Botenstoffe werden von den Zellen nach einem ganz bestimmten Bauplan aus einzelnen Aminosäuren gebildet. Deren Anordnung entscheidet darüber, welche dreidimensionale Struktur ein Interleukin ausbildet und damit welche Informationen es übertragen kann.
Menschen und Mäuse haben dabei ein ähnliches, aber doch unterschiedliches Vokabular. Einen auffälligen Unterschied entdeckten die Forscher beim Interleukin-27-alpha. Dieses kann von Zellen im Immunsystem der Maus – nicht aber von menschlichen Zellen – freigesetzt und zur Kommunikation genutzt werden.
„Mit Hilfe von Computermodellen und zellbiologischen Experimenten konnten wir aufdecken, dass nur eine einzige strukturell wichtige Aminosäure entscheidet, ob Interleukin-27-alpha von Zellen des Immunsystems freigesetzt wird“, erklärt Stephanie Müller, die Erstautorin der Studie „Das brachte uns auf die Idee, wie wir humane Interleukin-Proteine so verändern können, dass sie nun von Zellen freigesetzt werden und wir sie biotechnologisch herstellen können.“
Proteine mit neuen Funktionen aus dem Labor
Das Team stellte daraufhin das modifizierte Interleukin im Labor her und untersuchte es anschließend auf seine biologische Funktion hin. Ergebnis: Der veränderte Botenstoff wird von menschlichen Zellen erkannt. Immunologische Analysen legen nahe, dass er tatsächlich eine überschießende Reaktion des Immunsystems unterdrücken kann, und damit ein aussichtsreicher Kandidat für eine Sepsis-Therapie ist.
„Damit ist es uns erstmals gelungen, das Vokabular der Botenstoffe zu erweitern und die Reaktion der Immunzellen gezielt zu modulieren. Dies war uns nur durch die enge Zusammenarbeit mit Immunologen und Medizinern der TUM, der Université Sorbonne in Paris und des Helmholtz Zentrums München möglich“, resümiert Feige. Das neue Protein wurde bereits zum Patent angemeldet.