Große Augen
MDC-Forscher klären Ursache genetischer bedingter Kurzsichtigkeit auf
„Großmutter, warum hast Du so große Augen?“ Diese Frage von Rotkäppchen aus dem gleichnamigen Grimm`schen Märchen hat nichts mit der Erkrankung zu tun, deren Ursache jetzt Dr. Annabel Christ und Prof. Thomas Willnow vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) aufgeklärt haben. Es handelt sich dabei um eine seltene, genetisch bedingte Vergrößerung des Augapfels, Buphthalmie genannt. Die Betroffenen sind stark kurzsichtig.
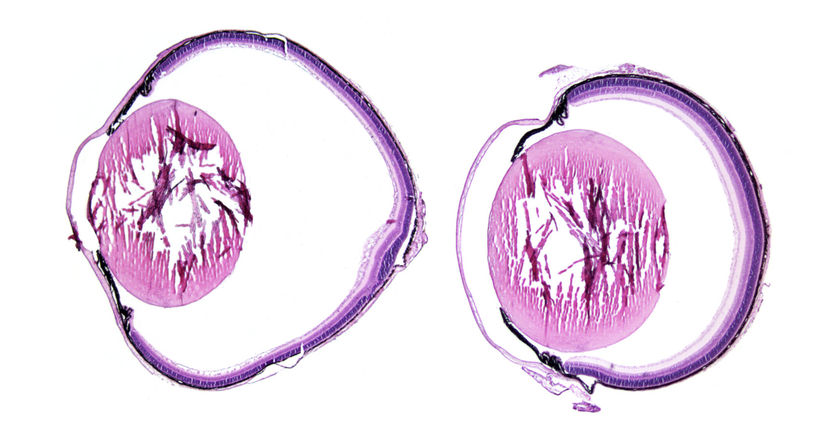
Bei Verlust des Rezeptors LRP2 verlängert sich der Augapfel (links) im Vergleich zu einem Auge mit intaktem LRP2-Rezeptor (rechts), histologische Präparate von Mäusen.
MDC
Die Augen von Babys sind schon fast so groß wie die eines Erwachsenen, denn das menschliche Auge wächst nach der Geburt nur noch wenig. Das ist bei Reptilien und Fischen anders. Deren Augen wachsen stetig, obwohl sie den gleichen Aufbau haben, wie die Augen der Säugetiere, also auch die des Menschen. Was das Wachstum des Säugerauges hemmt, war bisher noch unverstanden. Bekannt war jedoch, dass ein zu starkes Wachstum des menschlichen Auges zu Kurzsichtigkeit führt, da der Augapfel zu lang wird und das ins Auge einfallende Licht nicht gezielt auf die Netzhaut treffen kann.
Dr. Christ, die als unabhängige Helmholtz-Stipendiatin (Helmholtz-Fellow) am MDC arbeitet, und Prof. Thomas Willnow haben jetzt einen Mechanismus aufgeklärt, welcher das Wachstum des menschlichen Auges kontrolliert und damit Kurzsichtigkeit verhindert. Ausgangspunkt ihrer Studien war eine seltene Form starker Kurzsichtigkeit, welche bei Patienten mit einem Gendefekt in einem Rezeptor auftritt, der als LRP2-Rezeptor bezeichnet wird. Stark vergrößerte Augen konnten die Wissenschaftler ebenfalls in Mäusen beobachteten, denen LRP2 im Auge fehlt.
Gemeinsam mit Augenspezialisten des Toronto Western Research Institutes in Kanada, und der Freien Universität Berlin gingen Dr. Christ, Prof. Willnow und ihre Kollegen am MDC der Frage nach, warum ein Defekt von LRP2 zu unkontrolliertem Wachstum des Säugerauges führt. In einer Studie, die jetzt die renommierte Fachzeitschrift Developmental Cell veröffentlicht hat, konnten sie zeigen, dass LPR2 in der Stammzellnische der Netzhaut sitzt. Dort sorgt LRP2 dafür, dass die Stammzellnische der Netzhaut im Säugerorganismus nicht überaktiv ist. Gegenspieler von LRP2 ist ein Signalmolekül, kurz SHH genannt (die Abk. steht für Sonic hedgehog), welches das Wachstum von Stammzellen anregt.
Seit langem ist bekannt, dass SHH die Embryonalentwicklung der Augen und die Ausbildung der Netzhaut mit ihren Stäbchen und Zäpfchen steuert. Dazu stimuliert es die Stammzellnische der Netzhaut. Im Säugerauge wird LRP2 am äußeren Rand der Netzhaut ausgebildet und fängt den Wachstumsfaktor SHH ab, bevor er die Spitze dieser Stammzellnische erreichen kann. So werden die Stammzellen am Rande der menschlichen Netzhaut nicht zum Wachstum angeregt und das Augenwachstum kontrolliert. Bei Patienten mit schwerer, genetisch bedingter Kurzsichtigkeit ist LPR2 mutiert und kann das zur Stammzellnische wandernde SHH-Signalmolekül nicht mehr abfangen. SHH aktiviert dann die Zellen der Stammzellnische – der Augapfel vergrößert sich stark.
Originalveröffentlichung
Meistgelesene News
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.