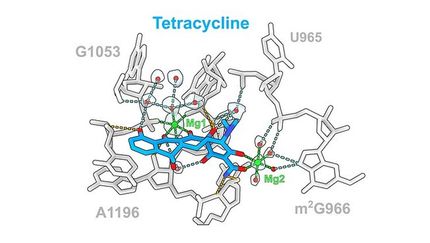
3-D-Bilder menschlicher Ribosomen in Aktion
Ribosomen sind Nanomaschinen, die aus dem genetischen Code neue Proteinstrukturen erzeugen und so die Grundlage des Lebens schaffen. Wissenschaftlern der Charité – Universitätsmedizin Berlin ist es gelungen, Einzelschritte der Proteinproduktion als räumliche Strukturen abzubilden. Die Ergebnisse der Studie wurden in der aktuellen Ausgabe der Fachzeitschrift Cell veröffentlicht.
Ribosomen sind große Molekülkomplexe, an denen – wie an einem Fließband – hunderte von Bausteinen zu neuen Proteinen zusammengesetzt werden. Sie lesen die in der Boten-Ribonukleinsäure (mRNA) kodierte genetische Information ab und nutzen diese, um Aminosäuren in der richtigen Reihenfolge zu Proteinen zusammenzusetzen. Diesen Schritt im Verlauf der Proteinbiosynthese nennt man Elongation. Bisherige Untersuchungen konzentrierten sich auf die einfacher aufgebauten bakteriellen Ribosomen, für deren Strukturaufklärung 2009 der Chemie Nobelpreis verliehen wurde. Offen geblieben ist bislang die Frage, wie sich die einzelnen Teilschritte der Elongation im Detail abspielen und wie sich das Ribosom – insbesondere bei höheren Säugern – dabei strukturell verändert.
Den Forschern um Prof. Dr. Christian Spahn, Direktor des Instituts für Medizinische Physik und Biophysik der Charité, ist es gelungen, den Elongationszyklus von menschlichen Ribosomen in verschiedenen Zwischenschritten abzubilden. Dazu verwendeten sie als Probe sogenannte Polysomen – die Aufreihung vieler aktiver Ribosomen entlang einer mRNA-Kette. Um den aktiven Zustand der Probe zu bewahren, wurden die Ribosomen in flüssigem Ethan schockgefroren und ihre dreidimensionale Struktur mittels Kryo-Elektronenmikroskopie rekonstruiert. Mit Hilfe eines rechenintensiven mathematischen Algorithmus konnten die Forscher insgesamt elf – teilweise bislang unbekannte – funktionelle Zustände identifizieren. Zudem erstellten sie das erste hochaufgelöste atomare Modell eines aktiven menschlichen Ribosoms. Ein solch detaillierter Bauplan hilft dabei, die Funktion der Ribosomen besser zu verstehen und könnte so die Entwicklung von neuartigen Medikamenten unterstützen.
„Faszinierend an der Studie ist nicht nur, dass wir eine Vielzahl unterschiedlicher Konformationen des menschlichen Ribosoms gleichzeitig abbilden können, sondern auch, dass wir Bilder von realen Zuständen aus der Zelle erhalten“, sagt Justus Loerke, Co-Autor der Studie. Er fügt hinzu: „So können wir wichtige Rückschlüsse über den Verlauf eines entscheidenden Schrittes der Proteinbiosythese ziehen.“ Sein Kollege Elmar Behrmann, mittlerweile Leiter einer Arbeitsgruppe am Bonner Forschungszentrum caesar, einem Institut der Max-Planck-Gesellschaft, ergänzt: „Aktive Proteine sind in der Regel in Bewegung. Um ihre Struktur zu ermitteln, werden sie häufig inaktiviert. Dieses ist bei unserem Ansatz nicht der Fall.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.