Proteinaggregate schützen Zellen im Alter
Forscher studieren altersbedingte Veränderungen im Proteinhaushalt
Während ein Organismus altert, kommt es in seinen Zellen zu einem allmählichen Verlust der Qualitätskontrolle für Proteine. Das führt vermehrt zu deren Verklumpen und der Bildung so genannter Aggregate. Mit einem umfassenden Ansatz haben Forscher um F.-Ulrich Hartl und Matthias Mann am Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München nun altersbedingte Änderungen in der Proteinzusammensetzung untersucht. Die in der Fachzeitschrift Cell publizierten Ergebnisse zeigen, dass im Laufe des Lebens die Mengenverhältnisse von Proteinen stark verschoben werden. Das wirft auch ein neues Licht auf die Herkunft und Funktion von Proteinaggregaten. An der Studie sind auch Wissenschaftler aus Cambridge (Christopher Dobson und Michele Vendruscolo), sowie aus Chicago (Richard Morimoto) beteiligt.
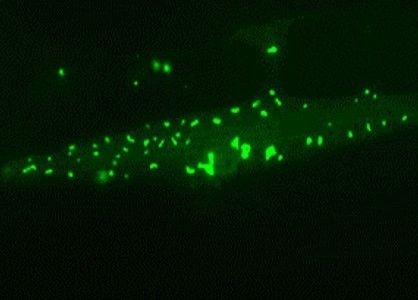
Muskelzelle eines langlebigen Fadenwurms: Chaperon-reiche Proteinaggregate (grün) reichern sich an und schützen die Zelle im Alter.
© Max-Planck-Institut für Biochemie / Prasad Kasturi
Altern ist ein komplexer biologischer Prozess, der häufig mit der Ablagerung von Proteinaggregaten in den Zellen einhergeht. Wissenschaftler nennen sie oft als Ursache für verschiedene neurodegenerative Erkrankungen wie Alzheimer, Chorea Huntington oder Parkinson. Ihre genaue Rolle ist aber noch nicht abschließend geklärt. Ein Forscherteam unter der Leitung von F.-Ulrich Hartl am Max-Planck-Institut für Biochemie verwendete jetzt den winzigen Fadenwurm Caenorhabditis elegans (kurz: C. elegans) als Modellorganismus, um zu analysieren, wie sich das Proteom, die Gesamtheit der Proteine, im Laufe des Lebens verändert. "Die Studie ist die umfangreichste ihrer Art und erfasst mehr als 5000 verschiedene Proteine zu mehreren Zeitpunkten während der Alterung", erklärt Prasad Kasturi, zusammen mit Dirk Walther Erstautor der Studie.
Die Forscher konnten zeigen, dass sich das Proteom der Würmer im Laufe der Zeit tatsächlich umfangreich wandelt. Die Mengen von etwa einem Drittel aller Proteine ändern sich deutlich und verschieben so deren ursprüngliches Verhältnis zueinander. Diese Umverteilung beeinträchtigt die korrekte Funktion der Proteine und überfordert darüber hinaus die Qualitätskontrolle der Zelle. In der Folge bilden überschüssige Proteine vermehrt Aggregate, was letztlich zum Tod der Tiere führt.
Auf diesen Ergebnissen aufbauend analysierten die Forscher, wie genetisch veränderte Würmer mit einer wesentlich längeren oder kürzeren Lebensdauer mit diesen Änderungen zurechtkommen. "In kurzlebigen Tieren ist das Ungleichgewicht der Proteine noch ausgeprägter und setzt früher ein. Im Gegensatz dazu zeigen langlebige Würmer eine Proteomzusammensetzung, die deutlich weniger von der der Jungtiere abweicht", so Kasturi. Überraschend war für die Wissenschaftler vor allem, dass speziell die langlebigen Würmer überschüssige und schädliche Proteine in Form von unlöslichen Aggregaten ablagerten und an diesen Stellen spezielle Hilfsproteine, so genannte Chaperone, konzentriert vorkamen. Da Chaperone anderen Proteinen helfen, ihre korrekte Faltung zu erlangen, vermuten die Forscher, dass so die funktionstüchtigen Proteine geschützt und die toxische Wirkung der Aggregate vermindert werden.
„Die Zellen bilden offenbar gezielt Chaperon-reiche Proteinaggregate als Schutzmechanismus - daher scheinen diese ein wichtiger Bestandteil des gesunden Alterns zu sein“, erklärt Katsuri. Tatsächlich ist bekannt, dass in den Gehirnen gesunder älterer Menschen unlösliche Proteinaggregate vorkommen. Bisher hatten Forscher angenommen, dass Neurodegeneration und Demenz vor allem durch veränderte Proteinvarianten in Aggregaten verursacht werden. Diese Annahme könnte nun auf dem Prüfstand stehen: "Aggregate sind eindeutig nicht immer schädlich. Die Suche nach Möglichkeiten, schädliche Proteine in Form von unlöslichen Ablagerungen zu konzentrieren, könnte eine nützliche Strategie sein, um altersbedingte, neurodegenerative Krankheiten zu bekämpfen", ordnet F.-Ulrich Hartl die Studie ein.
























































