Forscher identifizieren „nahezu ursprüngliche menschliche Stammzellen“
Auf der Suche nach der ursprünglichen, „naiven“ humanen embryonale Stammzelle (hES), die sich in einem so frühen Entwicklungsstadium befindet, dass sich aus ihr noch alle Zellen und Gewebe des Körpers entwickeln können, sind Forscher vom Max-Delbrück-Centrum für Molekulare Medizin (MDC) Berlin-Buch und der Universität Bath (England) offenbar fündig geworden. In Kulturen mit hES-Zellen und humanen induzierten pluripotenten Stammzellen (hiPS) identifizierten sie eine Untergruppe von Zellen, die diesem optimalen, pluripotenten oder naiven Stadium sehr nahe kommt. Jichang Wang, Gangcai Xie und Dr. Zsuzsanna Izsvák (MDC) sowie Prof. Laurence D. Hurst (Universität Bath) entdeckten auch den Mechanismus, wie sich diese „naiven“ Stammzellen formieren. Zugleich geben ihre Erkenntnisse Rätsel zur Evolution auf.
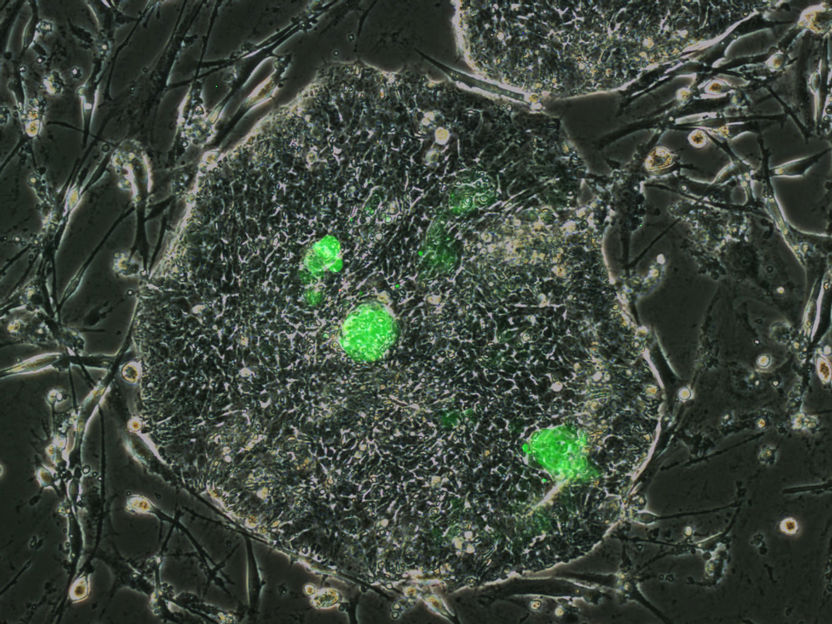
Neu entdeckte nahezu ursprüngliche humane Stammzellen (grün) in einer Kulturschale mit humanen embryonalen Stammzellen.
Jichang Wang/ Copyright: MDC
Embryonale Stammzellen des Menschen unterscheiden sich erheblich von embryonalen Stammzellen der Maus. Naive Stammzellen der Maus ähneln der inneren Zellmasse, aus der sich der Embryo entwickelt, was auf die humanen embryonalen Zelllinien, mit denen Forscher in den Labors arbeiten, nicht zutrifft. Naive oder ursprüngliche embryonale Maus-Stammzellen können sehr gut im Labor gezüchtet werden, das geht mit ursprünglichen humanen Zellen nicht. Warum, ist unklar. Möglicherweise, so vermuten Forscher, befinden sich die hES-Zellen im Labor im einem weiter vorangeschrittenen Entwicklungsstadium, als die pluripotenten ES-Zellen der Maus, und haben deshalb teilweise ihre Pluripotenz verloren.
Was also ist eine ursprüngliche humane pluripotente Stammzelle? Welche Merkmale hat sie? Lässt sie sich identifizieren, isolieren, im Labor vermehren und in Zellkultur halten? Die Klärung dieser Fragen, mit denen sich Forschungslabors in Europa, Asien und den USA befassen, ist die Voraussetzung dafür, diese Zellen künftig für die Entwicklung von Therapien nutzen zu können.
Evolution brachte sie auf die Spur
Die Evolution brachte die Forscher in Berlin und Bath schließlich auf die Spur. Sie folgten Hinweisen, wonach sich einige Viren in die DNA des Menschen integrieren und im sehr frühen Embryonalstadium aktiv werden. Dabei stießen sie auf eine Klasse von Retroviren, die in der Fachsprache als humane endogene Retroviren H (HERVH) bezeichnet werden. Sie haben sich vor Millionen von Jahren in die DNA integriert. Obwohl sie nicht mehr als Viren fungieren, werden sie aber zu einem sehr frühen Zeitpunkt im menschlichen Embryo aktiv, zu dem die Entwicklung naiver embryonaler Stammzellen zu erwarten wäre. Das hatte fast zum gleichen Zeitpunkt wie Dr. Izsvák und Prof. Hurst auch die Forschungsgruppe von Prof. Kazutoshi Takahashi von der Universität von Kyoto in Japan, beschrieben.
Dr. Izsvák und Prof. Hurst konnten aber noch einen Schritt weiter gehen. Es gelang ihnen, den Schalter zu identifizieren, der HERVH steuert. In Kulturen mit humanen embryonalen Stammzellen und humanen induzierten pluripotenten Stammzellen – sie wurden aus Hautzellen von Menschen gewonnen und mit einem Gencocktail in ein früheres Entwicklungsstadium umprogrammiert – konnten sie zeigen, dass der Transkriptionsfaktor LBP9 die Aktivität von HERVH in humanen embryonalen Stammzellen des Menschen reguliert. LBP9 schaltet in HERVH Gensequenzen an, die wiederum verschiedene Gene in den ES-Zellen in Gang setzen, die sie in das Stadium der Pluripotenz bringen. Dr. Izsvák, Prof. Hurst und ihre Mitarbeiter setzen ein Reporter-System ein, das die Zellen, die HERVH über den Faktor LBP9 anschalten, grün leuchten lässt. Damit konnten sie in der Zellkultur humane Stammzellen identifizieren, die das Virus HERVH über den Transkriptionsfaktor LBP9 anschalten und alle wichtigen Merkmale einer naiven humanen Stammzelle tragen.
„Unsere humanen sehr frühen Stammzellen sind den naiven Stammzellen der Maus bemerkenswert ähnlich“, erklärt Dr. Wang, Erstautor der Nature-Publikation. „Sie wachsen wie die naiven Stammzellen der Maus und schalten auch viele derselben Gene an, wie etwa Nanog, KLF4 und Oct4. Wenn wir den Transkriptionsfaktor LBP9 oder das Virus HERVH in den humanen Zellen herunterschalten, sehen sie nicht mehr wie ursprüngliche humane embryonale Stammzellen aus“. Dieser Transkriptionsfaktor spielt, wie Dr. Izsvák und Prof. Hurst zum Zeitpunkt ihrer Entdeckung nicht wissen konnten, auch bei naiven embryonalen Stammzellen der Maus eine Rolle, wie die Forschungsgruppe des Stammzellforschers Prof. Austin Smith von der University of Cambridge (England) gezeigt hatte. Der Faktor trägt bei der Maus nur einen anderen Namen - Tfcp2l1.
Als nächstes wird es darauf ankommen, die dem naiven-Stadium ähnlichen Stammzellen zu isolieren, in Kultur zu halten und zu vermehren. „HERVH könnte auch klären helfen, wie humane Stammzellen am besten in Kultur gehalten werden können“, so Dr. Izsvák. „HERVH unterdrückt die Weiterentwicklung der Stammzelle, weshalb wir davon ausgehen, dass HERV nur kurzzeitig angeschaltet wird, denn sonst könnte sich nie ein Embryo entwickeln. Welche Faktoren bei der Ausbalancierung dieses Prozesses eine Rolle spielen, wissen wir nicht“.
Was die Forscher in Berlin und Bath stutzig macht, ist die Tatsache, dass das Virus HERVH nur in Primaten – also in Affen und auch im Menschen – nachgewiesen worden ist, nicht aber in Mäusen. „Als Evolutionsbiologe finde ich das sehr seltsam“, so Prof. Hurst, „Denn eigentlich würde man vermuten, dass ein so grundsätzlicher Mechanismus wie die Pluripotenz zwischen zwei Spezies von Säugetieren in der Evolution konserviert ist“. „Es wird noch seltsamer“ so Dr. Izsvák. „Wir haben ein Gen entdeckt, kurz ESRG genannt, dessen Gensequenz fast vollständig von dem Virus HERVH abstammt. Wir wissen nicht, welche Rolle ESRG im Genom des Menschen spielt. Wenn wir es aber herunterschalten, verlieren die humanen Stammzellen ihre Pluripotenz. ESRG ist aber nur beim Menschen zu finden, selbst unsere nächsten Verwandten, die Affen, haben dieses Gen nicht.“
„Dieser von HERVH getriebene, nur beim Menschen vorkommende Schaltkreis, könnte zumindest teilweise erklären, weshalb embryonale Stammzellen des Menschen sich so grundlegend von embryonalen Stammzellen der Maus unterscheiden“, so Dr. Izsvák. Sie schlägt deshalb vor, humane ursprüngliche Stammzellen künftig mit der humanen inneren Zellmasse zu vergleichen, statt mit naiven Mausstammzellen.
„Wie hat sich dieser Schaltkreis für uns Menschen entwickelt“, fragt Prof. Hurst. „Das ist wirklich ein Rätsel. Weshalb sollte die Evolution mit etwas herumbasteln, mit dem offensichtlich nicht herumgebastelt werden muss? Wir wissen, dass einige Proteine, die mit LBP9 in Verbindung stehen, für die Unterdrückung von Viren wichtig sind – vielleicht liegt ja darin des Rätsels Lösung?“
Originalveröffentlichung
Jichang Wan et al.; Primate-specific endogenous retrovirus driven transcription defines naïve-like stem cells; Nature.
Ohnuki et. al. Dynamic regulation of human endogenous retroviruses mediates factor-induced reprogramming and differentiation potential, PNAS, 111, 12426-12431, August 26, 2014
Martello et. al. Identification of the missing pluripotency mediator downstream of leukaemia inhibitory factor EMBO J. 32, 2561-2574, 13 August 2013





















































