Grundlage für bessere Antibiotika
Forscher der ETH Zürich entschlüsseln die Struktur der grossen Untereinheit des Ribosoms der Mitochondrien bis ins atomare Detail. Dies ermöglicht nie dagewesene Einblicke in die molekulare Architektur dieses Ribosoms und in die Wirkungsweise von Antibiotika.
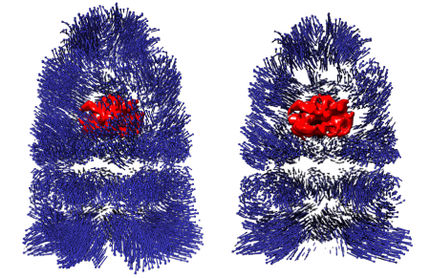
Ein Team von Forschenden der ETH Zürich rund um die Professoren Nenad Ban und Ruedi Aebersold hat die hoch komplexe molekulare Struktur der Mitoribosomen, den Ribosomen von Mitochondrien, aufgeklärt. Ribosomen kommen in den Zellen aller lebenden Organismen vor. Allerdings weisen höhere Organismen (Eukaryoten), zu denen neben Pilzen, Pflanzen und Tieren auch Menschen zählen, wesentlich komplexere Ribosomen auf als Bakterien. Bei Eukaryoten lassen sich die Ribosomen zudem in zwei Typen unterteilen: diejenigen im Cytosol, dem Grossteil der Zelle, und jenen in den Mitochondrien, den Kraftwerken der Zellen. Mitochondrien kommen dabei nur bei Eukaryoten vor.
Ribosomen dienen als Dechiffriergerät und sind eng in den Entstehungsprozess von Proteinen eingebunden. Jedes Ribosom besteht aus zwei Untereinheiten. Die kleinere Untereinheit decodiert mit Hilfe von Transfer-Ribonukleinsäuren (Transfer-RNS oder tRNS) den genetischen Code, der in Form einer Boten-RNS angeliefert wird. Die grössere Untereinheit fügt die durch die Transfer-RNS gelieferten Aminosäuren wie Perlen zu einer Protein-Kette zusammen.
Noch höhere Auflösung, noch mehr Details
Mitochondrielle Ribosomen sind besonders schwierig zu untersuchen, da sie nur in geringer Zahl auftreten und schwer zu isolieren sind. Bereits zu Jahresbeginn hatten die ETH-Forschenden die molekulare Struktur der grossen Untereinheit des Mitoribosoms von Säugetierzellen bis zu einer Auflösung von 4,9 Angström (weniger als 0,5 Nanometer) aufgeklärt. Allerdings war diese Auflösung nicht hoch genug, um zuverlässig ein atomares Modell der damals unbekannten Struktur zu bauen. Dies ist dem Team von ETH-Professor Nenad Ban jetzt gelungen. Sie konnten die gesamte Struktur bei 3,4 Angström (0,34 Nanometer) entschlüsseln. Ihre Erkenntnisse publizierten die Wissenschaftler soeben in der Fachzeitschrift «Nature».
Bei den Untersuchungen kamen die hochauflösende Kryo-Elektronenmikroskopie am Elektronenmikroskopie-Zentrum der ETH Zürich (ScopeM) und modernste Methoden der Massenspektrometrie zum Einsatz. Aufgrund jüngster technischer Fortschritte in der Kryo-Elektronenmikroskopie und der Entwicklung von Elektronenkameras, die selbst geringste Bewegungen korrigieren können, ist es seit kurzem möglich, Biomoleküle mit einer Auflösung von weniger als vier Angström aufzunehmen.
Wirkung von Antibiotika verbessern
Die neuen Bilder zeigen insbesondere die detaillierte Ansicht des Peptidyl-Transferase-Zentrums (PTC), also dem Ort, wo die Aminosäurebausteine verbunden werden. Die so synthetisierten Proteine durchqueren dann einen Tunnel, über welchen sie die grosse Untereinheit des Ribosoms schliesslich verlassen.
«Dieser Vorgang ist medizinisch von Bedeutung», sagt Basil Greber, Erstautor der Studie und Post-Doktorand in Nenad Bans Gruppe. Denn dieser Tunnel wird als Angriffspunkt für bestimmte Antibiotika genutzt: Das Antibiotikum setzt sich im Tunnel fest und hindert die frisch erzeugten Proteine daran, diesen zu verlassen. Allerdings sollen Antibiotika nur die Proteinsynthese bei den Ribosomen von Bakterien hemmen.
«Damit ein Antibiotikum beim Menschen eingesetzt werden kann, darf es nicht die menschlichen Ribosomen angreifen», erklärt Greber. Antibiotika dürfen die Proteinsynthese nur bei bakteriellen Ribosomen hemmen. Das Problem aber ist, dass mitochondrielle Ribosomen denen von Bakterien gleichen. Darum stören gewisse Antibiotika auch die Mitoribosomen. «Dies kann zu schwerwiegenden Nebenwirkungen führen.» Dank der Ergebnisse der ETH-Forschenden lassen sich künftig Antibiotika designen, die nur bakterielle und nicht mitochondrielle Ribosomen hemmen. Eine Grundvoraussetzung dafür, dass sie in der Klinik eingesetzt werden können.
Überraschende Entdeckung
Die ETH-Forschenden machten zudem eine unerwartete Entdeckung. Sie stellten fest, dass die Mitoribosomen Transfer-RNS auf zwei grundsätzlich verschiedene Arten einsetzen. Zum einen verwenden sie tRNS, um die richtige Aminosäure für die Peptidsynthese im PTC auszuwählen. Zum anderen ist eine tRNS, anders als bei allen übrigen Ribosomen, fest in die Struktur eingebaut. Dadurch wird eine Ribonukleinsäure (RNS), die im Laufe der Evolution verloren gegangen ist, funktionell ersetzt. Es war zwar seit längerem bekannt, dass mitochondrielle Ribosomen während ihrer Entwicklung neue Proteine in ihre Struktur integriert hatten. Erstmals wurde aber beobachtet, dass ein komplett neues RNS-Molekül verwendet wird. «Das zeigt, wie anpassungsfähig Mitoribosomen sind», betont Greber.
Bei seinen Forschungen steht das ETH-Team nun vor der grossen, bislang ungelösten Aufgabe, die Struktur der kleineren Untereinheit des mitochondriellen Ribosoms zu bestimmen. Da diese flexibler ist als die grosse Untereinheit, ist dies eine noch grössere Herausforderung.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!