Immunsystem um 500 Millionen Jahre zurückgedreht
Anzeigen
Wissenschaftler am Max-Planck-Institut für Immunbiologie und Epigenetik (MPI-IE) in Freiburg reaktivierten dafür ein sehr ursprüngliches Gen, das im Immunsystem von Säugetieren normalerweise nicht abgelesen wird. Der Thymus, ein zentrales Immun-Organ, entwickelte sich daraufhin wie bei Fischen. Zur Überraschung der Forscher produzierte der zurückgesetzte Thymus nicht nur T-Zellen, wie es bei Säugetieren der Fall ist. Auch B-Zellen reiften dort heran – eine Eigenschaft, die sonst nur von Fischen bekannt ist. Das Modell könnte damit eine Erklärung bieten, wie sich das Immunsystem im Laufe der Evolution entwickelt hat. Die Studie ist nun in Cell Reports erschienen.
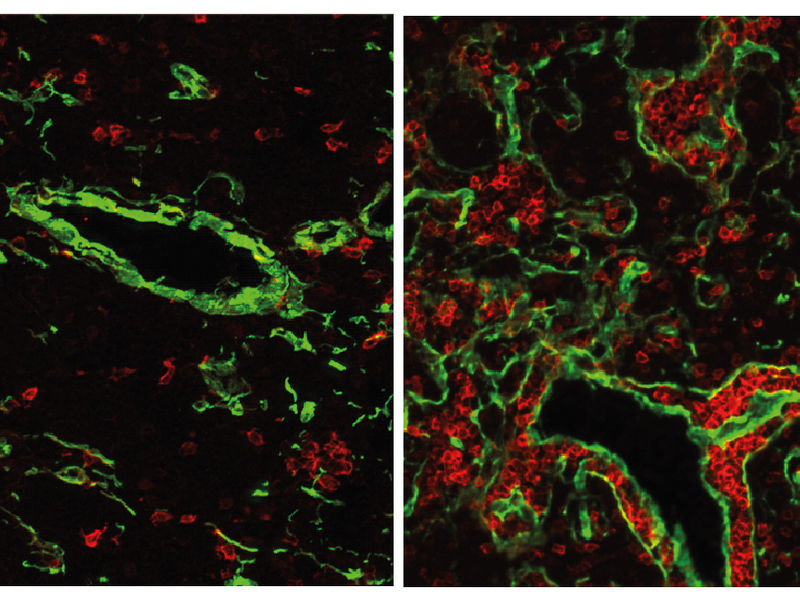
Der normale Thymus einer Maus (links) enthält nur wenige B-Zellen (rot). Wenn das Gen FOXN4 aktiviert wird, entwickelt sich ein fisch-ähnlicher Thymus mit vielen B-Zellen. Dieser Zustand hat vermutlich vor 500 Millionen Jahren existiert, als die ersten Wirbeltiere auftraten.
© Max Planck Institute of Immunobiology & Epigenetics
Die erworbene oder adaptive Immunantwort ist einzigartig für Wirbeltiere. Eines der zentralen Organe dieser Abwehr ist der Thymus, den alle existierenden Wirbeltierarten besitzen. Unter Regie der Thymus-Epithelzellen reifen dort T-Zellen heran, die später entartete oder infizierte Körperzellen bekämpfen sollen. Das Gen FOXN1 ist für die Entwicklung solcher T-Zellen im Thymus von Säugetieren verantwortlich. Wissenschaftler um Thomas Boehm, Direktor am MPI-IE und Leiter der Abteilung für die Entwicklung des Immunsystems, aktivierten nun in den Thymus-Epithelzellen von Mäusen - anstelle von FOXN1 - dessen evolutionären Vorfahren, FOXN4. Dieses Gen ist zwar in allen Wirbeltieren vorhanden, scheint aber nur in bestimmten Fischarten, etwa Katzenhaien und Zebrafischen, eine Rolle bei der Reifung von Immunzellen zu spielen.
“Die gleichzeitige Aktivität von FOXN1 und FOXN4 in Mäusen führte zu einem Thymus, der mit dem Thymus von Fischen vergleichbar ist”, beschreibt Erstautor Jeremy Swann die Beobachtung. Zusammen mit früheren Studien deutet das darauf hin, dass die Entwicklung und Funktion von Thymus-Gewebe ursprünglich durch FOXN4 in Gang gebracht wurde. Nach einer evolutionären Genverdopplung, die zu FOXN1 führte, waren im Thymus vermutlich erst beide Gene und schließlich nur noch FOXN1 aktiv.
Überraschend für die Wissenschaftler war, dass sich im Thymus der Mäuse neben T-Zellen auch B-Zellen entwickelten. B-Zellen sind später für die Antikörper-Produktion verantwortlich und reifen in Säugetieren nicht im Thymus, sondern in anderen Organen heran, wie etwa dem Knochenmark. “Unsere Studie liefert ein plausibles Szenario, das den Übergang eines bipotenten, also für B- und T-Zellen wichtigen, Gewebes hin zu einem auf T-Zellen spezialisierten Thymus beschreibt”, sagt Boehm. Da die Vorläuferzellen von B-und T-Zellen derzeit noch nicht unterschieden werden können, lässt sich nicht sagen, ob die B-Zell-Entwicklung auf dem Einwandern entsprechender B-Zell-Vorläufer oder auf der Reifung von gemeinsamen B- und T-Zell-Vorläufern im Thymus basiert.
Häufig deuten die Studien darauf hin, dass der Ursprung einer evolutionären Innovation in einer bereits ausgestorbenen Art liegt. „Hier kann die Wiederherstellung und funktionelle Untersuchung vermuteter früherer Stadien wesentliche Einblicke in den Verlauf solcher Neuentwicklungen bieten“, erklärt Boehm den Studienansatz.
Originalveröffentlichung
Swann JB et al.; Conversion of the thymus into a bi-potent lymphoid organ by replacement of Foxn1 with its paralog Foxn4; Cell Reports, 14 July 2014






















































