Rhesus-Proteine verladen Ionen, nicht Gas
In synthetischen Lipidvesikeln zeigen Biochemiker, wie Membranproteine Ammonium transportieren
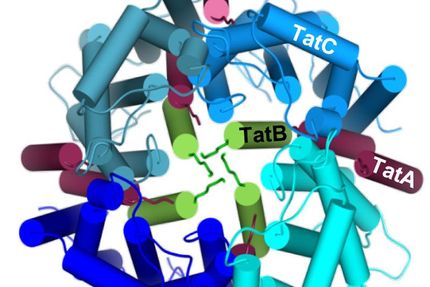
Haben die Proteine das Gas Ammoniak oder das Ion Ammonium im Gepäck? Und ist das ein aktiver oder ein passiver Transport? Lange rätselten Biochemiker über die Eigenschaften der Ammoniumtransportproteine (Amt), zu denen auch der Rhesus-Faktor, der als Blutgruppensystem bekannt ist, gehört. Bekannt war bisher, dass die Amt-Proteine Stickstoff in Bakterienzellen transportieren – in Pflanzen und Bakterien sind sie für dessen Aufnahme unerlässlich. Bei Mensch und Tier regulieren sie den Säure- und Ionenhaushalt des Körpers. Ein Team von Wissenschaftlern um Prof. Dr. Susana Andrade vom Institut für Biochemie der Universität Freiburg und Mitglied des Exzellenzclusters BIOSS Centre for Biological Signalling Studies, hat mit elektrophysiologischen Tests an synthetischen Lipidvesikel die Eigenschaften des Amt-Proteins mit großer Genauigkeit bestimmt.
Die Wissenschaftler verwendeten Proteine, die aus der Zellmembran von so genannten Archaeen stammen, Einzellern, die unter extremen Umweltbedingungen leben. Die Freiburger Forscher klärten bereits 2005 die Kristallstruktur eines solchen Proteins auf. Nun fügten sie die Proteine in eine Schicht von Lipidmolekülen ein, an der sie Ionenströme direkt messen können. Das Team entdeckte, dass eine positive Ladung durch die Membran wandert: Nicht das Gas Ammoniak NH3, sondern das Ammonium-Ion NH4+ wird transportiert. Ihre Ergebnisse haben die Forscher in der Fachzeitschrift „Proceedings of the National Academy of Sciences of the USA“ veröffentlicht.
„Die Erkenntnisse lassen sich zum großen Teil auf die Rhesus-Proteine der Säuger übertragen“, sagt Andrade. Die Amt-Proteine ähneln stark den Rhesus-Proteinen des Menschen. Die Forscher testeten drei Amt-Proteine, die in den Bakterien vorkommen und bestimmten außerdem die Geschwindigkeit, mit der sie Ammonium durchlassen. „In Zukunft wollen wir einzelne Komponenten des Transporters verändern, um die genauen chemischen Vorgänge besser zu verstehen“, erklärt Andrade.
Der wissenschaftliche Streitpunkt um das Amt-/Rh-Protein entstand aus der Schwierigkeit, Ammoniak und Ammonium in Messungen zu unterscheiden, da die beiden Moleküle in einem ständigen Gleichgewichtsverhältnis mit Protonen ineinander umgewandelt werden. „Mit unserer In-vitro-Methode erreichen wir eine Genauigkeit, die endlich gültige Schlussfolgerungen über den Transportprozess zulässt.“ betont die Forscherin.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.