Struktur bakterieller Giftspritze aufgeklärt
Anzeigen
Für die Infizierung von Zellen besitzen Bakterien spezielle Sekretionssysteme. LMU-Forscher haben nun die Struktur eines wichtigen Bauteils dieser Exportmaschinen aufgeklärt – möglicherweise ein vielversprechender Ansatzpunkt für neue Antibiotika.
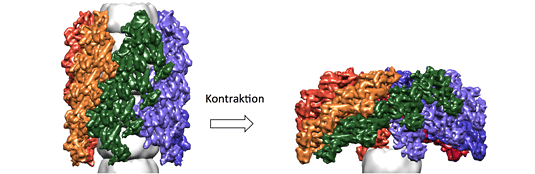
Im Modell des nicht kontrahierten Type VI Sekretionsapparats (links) umschließt der Röhrenkomplex einen giftbeladenen Nadelkomplex (grau). Durch eine Kontraktion des Komplexes (rechts) wird dieser vom Bakterium auf eine andere Zelle abgeschossen.
LMU
Bakterien kommunizieren mit ihrer Umwelt, indem sie eine breite Palette unterschiedlicher Proteine ausscheiden. Wie eines der dafür notwendigen Transportsysteme – das Typ VI Sekretionssystem – aufgebaut ist, hat nun die Biochemikerin Petra Wendler vom Genzentrum der LMU in Zusammenarbeit mit Axel Mogk am ZMBH (Zentrum für molekulare Biologie Heidelberg) untersucht. „Bakterien nutzen dieses Sekretionssystem vor allem zur Bekämpfung von konkurrierenden Spezies und zum Angriff auf Wirtszellen, indem sie verschiedene Effektorproteine oder Gifte wie mit einer Nanospritze aus der Zelle herausschießen“, sagt Wendler.
Typ VI Sekretionssysteme wurden erst vor wenigen Jahren entdeckt. Sie kommen in zahlreichen Bakterienarten vor, darunter sind auch viele wichtige Krankheitserreger wie der Cholerabazillus Vibrio cholerae, oder Pseudomonas aeruginosa, der Erreger der Lungenentzündung. Da immer mehr Bakterienspezies gegenüber Antibiotika resistent sind, ist die Erforschung alternativer Angriffspunkte für ihre Bekämpfung dringend erforderlich. Bakterielle Sekretionssysteme sind dabei ein viel versprechender Angriffspunkt, da entsprechende Wirkstoffe pathogene Bakterien sehr gezielt entwaffnen könnten.
Kontrahierbarer Komplex schießt aus der Zelle
„Um geeignete Angriffspunkte im bakteriellen Sekretionssystem zu identifizieren, brauchen wir aber mehr Einblick in diese zellulären Exportmaschinen“, sagt Wendler. „Vor kurzem wurde ein röhrenförmiger Proteinkomplex entdeckt, der kontrahieren und dabei Gifte aus der Zelle herausschießen kann. Neben seiner Eignung als potenziellen Angriffspunkt für neue Antibiotika interessierte uns vor allem die Aufklärung des völlig energieunabhängigen Kontraktionsmechanismus des Komplexes“. Zur Beantwortung beider Fragestellungen sind detaillierte Kenntnisse der Struktur des Komplexes notwendig – dazu konnte Wendler mit ihrem Team nun beitragen.
„Wir konnten die kontrahierte Form des Komplex bis auf Subnanometer genaue Auflösung aufklären und zeigen, dass die Architektur und die inneren strukturgebenden Teile des Komplexes mit bestimmten Viren-Proteinen verwandt sind, aber evolutionär an ihre Funktion als Sekretionssystem angepasst wurden“, erklärt Wendler. So ist die Erkennungsstelle für ein Abbruchprotein, das den Komplex nach Sekretion der pathogenen Effektoren recycelt, in der von Wendler aufgeklärten kontrahierten Form des Komplexes sehr gut zugänglich. In einem Modell der nicht-kontrahierten Form dagegen ist die Erkennungsstelle für das Abbruchprotein in der Röhrenwand versteckt – so werden nur Komplexe recycelt, die ihre "Giftpfeile" bereits verschossen haben.
Als nächsten Schritt will Wendler die Auflösung der Strukturanalysen weiter verbessern und auch die Struktur des nicht-kontrahierten Sekretionsapparats detailliert aufklären, um Einblick in den Kontraktionsmechanismus zu bekommen. „Die umfassende Aufklärung der Bestandteile und der Funktionsweise des Sekretionssystems könnte dann neue Chancen für die Entwicklung neuer wirksamer Antibiotika eröffnen“, sagt Wendler.