Einblick in die Struktur eines Proteintransporthelfers
Proteine sind die molekularen Baustoffe und Maschinen der Zelle und an praktisch allen Lebensprozessen beteiligt. Um ihre Aufgaben korrekt ausführen zu können, werden viele Proteine nach ihrer Herstellung mit Anhängen wie Zuckerresten versehen. Dieser Prozess ist direkt an den Transport durch eine Membran gekoppelt. Wissenschaftlern am Max-Planck-Institut (MPI) für Biochemie ist es jetzt mit Hilfe verschiedener strukturbiologischer Methoden gelungen, einen Einblick in die Architektur des verantwortlichen Proteinkomplexes (ER-Translokon) zu gewinnen. Die Ergebnisse des Gemeinschaftsprojekts wurden jetzt in Nature Communications veröffentlicht.
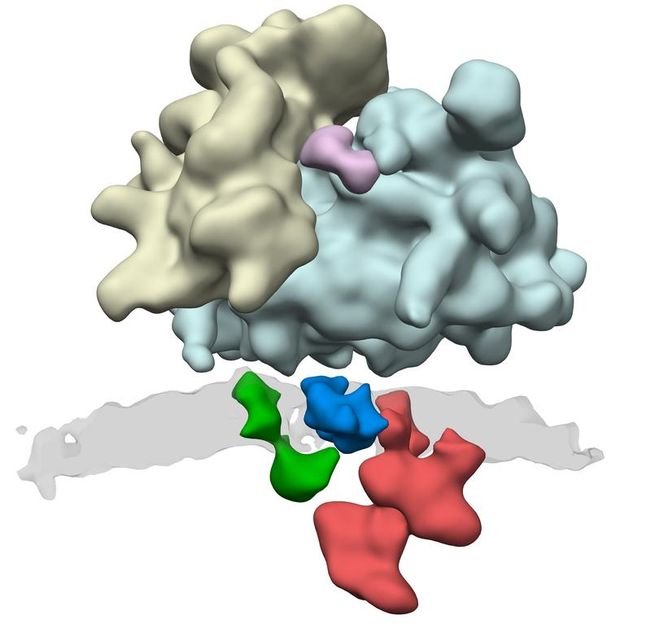
Viele Proteinkomplexe sind an der Synthese von Eiweißen beteiligt. Durch das ER-Translokon (grün, blau und rot) wird das neu synthetisierte Protein über die Membran (grau) in das ER geschleust.
Grafik: Friedrich Förster / Copyright: MPI für Biochemie
Ein Protein herzustellen, ist für die Zelle ein hoch komplexer Prozess und beinhaltet viele einzelne Schritte. Je nachdem für welchen Zweck ein Protein gebraucht wird, gibt es verschiedene Orte der Proteinproduktion: das Zellinnere, auch Zellplasma genannt, oder das Endoplasmatische Retikulum (ER). Das ER ist durch eine Membran von seiner Umgebung, dem Zellplasma, getrennt. Proteine, die am ER hergestellt werden, gelangen noch während der Synthese über diese Membran in das Innere des ERs und werden dabei durch das Anhängen von Zuckerresten verändert. Ohne diese Anhänge können sich Proteine nicht korrekt falten und so auch ihre Aufgaben in der Zelle nicht erfüllen.
Wissenschaftler der Forschungsgruppe „Modellierung von Proteinkomplexen“ konnten jetzt die Architektur des Proteinkomplexes beschreiben, der für den Transport und die Veränderung des neu produzierten Proteins verantwortlich ist: das ER-Translokon. „Es befindet sich in der Membran des ERs, was neben seiner Größe und komplexen Zusammensetzung bisherige strukturelle Untersuchungen erheblich erschwert hat“, beschreibt Friedrich Förster, Gruppenleiter am MPI für Biochemie, die Ausgangssituation. Die Strukturen vieler Untereinheiten sowie ihre Anordnung im Gesamtkomplex des ER-Translokons waren daher bisher unbekannt.
Erst durch die Verwendung der Kryo-Elektronentomographie konnten die Forscher einen ersten Einblick in die Architektur des ER-Translokons erhalten. Die Probe wird „schockgefroren“, sodass ihre natürliche Struktur erhalten bleibt. Dann nehmen die Wissenschaftler aus verschiedenen Blickwinkeln zweidimensionale Bilder des Objekts im Elektronenmikroskop auf, aus denen sie schließlich ein dreidimensionales Bild rekonstruieren. Weitere Untersuchungen machten es möglich, einzelne Untereinheiten in der Struktur zu identifizieren. Darunter ist auch die Untereinheit, die Zuckerreste an das neu produzierte Protein knüpft.
„Basierend auf dieser Methodik wollen wir jetzt versuchen, die Struktur und Lage weiterer Komponenten des ER-Translokons zu bestimmen“, so Förster. Kennen die Forscher die einzelnen Strukturen des ER-Translokons, können sie indirekt auf die genaue Funktionsweise und das Zusammenwirken aller Bestandteile rückschließen.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Pfeffer, S., Dudek, J., Gogala, M., Schorr, S., Linxweiler, J., Lang, S., Becker, T., Beckmann, R., Zimmermann, R., Förster, F.: Structure of the mammalian oligosaccharyl-transferase complex in the native ER protein translocon. Nature Commun, January 10, 2014
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.