Enzym stoppt Alterungsprozesse in Zellen
Reparaturenzym beseitigt durch freie Radikale verursachte DNA-Schäden
Jede Zelle benötigt zur Verrichtung ihrer Aufgabe Energie, die sie in zelleigenen Kraftwerken selbst produziert, den Mitochondrien. Diese arbeiten allerdings nicht fehlerfrei, so dass sogenannte freie Radikale entstehen. Die Zellgifte schädigen unter anderem die Mitochondrien-eigene DNA. Wissenschaftlern vom Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim ist es nun zusammen mit einem internationalen Forscherteam gelungen, in Herzmuskelzellen von Mäusen einen Schutzmechanismus zu installieren, der die Schäden an der Mitochondrien-DNA weitestgehend verhindert. Sie hoffen, dass sie damit einen Ansatz gefunden haben, wie die Zellalterung wirksam verhindert werden kann.
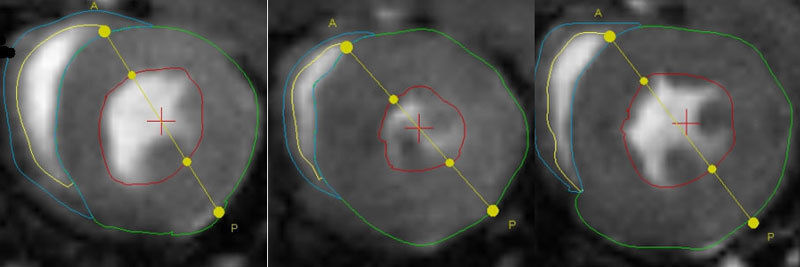
Twinkle hält das Herz jung: Die Abbildungen zeigen Querschnitte durch die beiden Herzkammern, aufgenommen mit Hilfe der Magnetresonanztomographie (MRT). Links das Herz einer Kontrollmaus. Mitte: Fehlt das Gen für einen Radikalenfänger, altert das Herz viel schneller. Dies zeigt sich in diesem Fall am kleineren Querschnitt des Herzens. Rechts: Wird zusätzlich das Reparaturenzym Twinkle verstärkt gebildet, behält das Herz seine normale Größe.
© MPI f. Herz- und Lungenforschung
Kaum ein anderer Zelltyp leistet derart viel wie Herzmuskelzellen. Für ihre Kontraktionsarbeit benötigen sie extrem viel Energie. Deshalb sind in Herzmuskelzellen besonders viele Mitochondrien zu finden. Diese Kraftwerke der Zelle produzieren den Treibstoff, das ATP. Ganz ähnlich wie bei Industriekraftwerken entstehen dabei Schadstoffe. Diese als freie Radikale bezeichneten hochreaktiven Substanzen entstehen in den Mitochondrien beim Veratmen von Sauerstoff, weil die Energiegewinnung an einigen Punkten nicht fehlerfrei abläuft.
Freie Radikale sind Zellgifte. Den Mitochondrien wird dabei vor allem zum Verhängnis, dass sie eine eigene Erbinformation besitzen, die Mitochondrien-DNA. Diese wird von den Radikalen attackiert. Über einen langen Zeitraum führt dies zu Schäden an der DNA und den Mitochondrien insgesamt, obwohl verschiedene Reparaturmechanismen existieren. Dieser Prozess wird als wesentlicher Faktor für die Alterung und das Absterben von Zellen angesehen.
Wissenschaftler aus der Arbeitsgruppe von Thomas Braun am Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim haben nun zusammen mit Kollegen aus den USA und Finnland nach Wegen gesucht, die Schädigung der Mitochondrien durch freie Radikale zu verhindern. Dabei verwendeten sie zunächst bestimmte gentechnisch veränderte Mäuse. Diesen fehlt ein Gen für ein Enzym, das eigentlich den größten Teil der entstehenden Radikale unschädlich macht. „Mäuse, denen das Enzym komplett fehlt, sterben gleich nach der Geburt. Deshalb haben wir bei unseren Mäusen lediglich eine der beiden Genkopien ausgeschaltet“, erklärt der Leiter der Studie Jaakko Pohjoismäki. Die Mäuse zeigten im Vergleich zu Kontrolltieren deutlich mehr Schäden an der Mitochondrien-DNA. In der Folge nahmen die Schäden am Herzmuskel mit zunehmendem Alter der Tiere zu. „Wir beobachteten typische alterungsbedingte Krankheitssymptome wie Herzmuskelschäden“, so Braun.
An derart vorbelasteten Tieren versuchten die Wissenschaftler nun die Reparatur der geschädigten DNA zu optimieren. „Die Mäuse erhielten eine zusätzliche Kopie eines Gens mit dem Namen Twinkle, das normalerweise in Herzmuskelzellen nur relativ schwach aktiv ist. Dieses kodiert für ein Enzym, das für die „Aufwicklung“ der Erbsubstanz DNA bei der Vermehrung von Mitochondrien zuständig und für die Reparatur der DNA wichtig ist“, erläutert Pohjoismäki. Ist es vermehrt aktiv, nimmt die mitochondriale DNA eine andere Organisationsform an, welche die DNA widerstandsfähiger oder einfacher reparierbar machen könnte.
Und genau dieses geschah nun bei den Mäusen: „Im Gegensatz zu den erwähnten Schädigungen bei den Mäusen ohne Twinkle blieben die Schäden an der Mitochondrien-DNA bei den Tieren mit erhöhter Expression von Twinkle weitestgehend aus“, sagt Pohjoismäki. Dadurch werden weniger Mitochondrien zerstört und weniger Herzmuskelzellen sterben ab. Folglich wird auch der Herzmuskel nicht geschädigt.
Aus Sicht der Max-Planck-Forscher ist es in der Studie gelungen, die Toleranz der Herzmuskelzellen gegen wichtige Zellgifte wie die freien Radikale zu steigern. „Freie Radikale spielen nicht nur bei der Zellalterung, sondern auch bei akuten Erkrankungen wie dem Herzinfarkt eine wichtige Rolle. Deshalb hoffen wir, dass wir die Grundlage für neue Therapien schaffen konnten“, so Braun. Zudem ergeben sich nach seiner Meinung auch Ansätze dafür, die durch die freien Radikale verursachten Alterungsprozesse in den Zellen zu verlangsamen.