Laufbursche des Immunsystems
Signalweg verbindet die lokale Immunabwehr mit einer pflanzenweiten Resistenz
Anzeigen
Wenn Pflanzen einen Krankheitserreger entdecken, bereiten sie sich auch auf einen systemischen Angriff vor. Sie wollen sich auf jeder Ebene wehren können. Annegret Roß und Yusuke Saijo vom Max-Planck-Institut für Pflanzenzüchtungsforschung in Köln und ihre Kollegen haben entdeckt, dass diese pflanzenweite Resistenz unter anderem durch einen Signalweg ausgelöst wird, der auf kurze Eiweißfragmente reagiert. Diese entstehen vermutlich dann, wenn die Pflanzenzelle beim Eintritt des Krankheitserregers verletzt wird. Der Signalweg schleust einen molekularen Vermittler ins Gefäßsystem der Pflanzen ein, der alle Bereiche in Alarmbereitschaft versetzt.
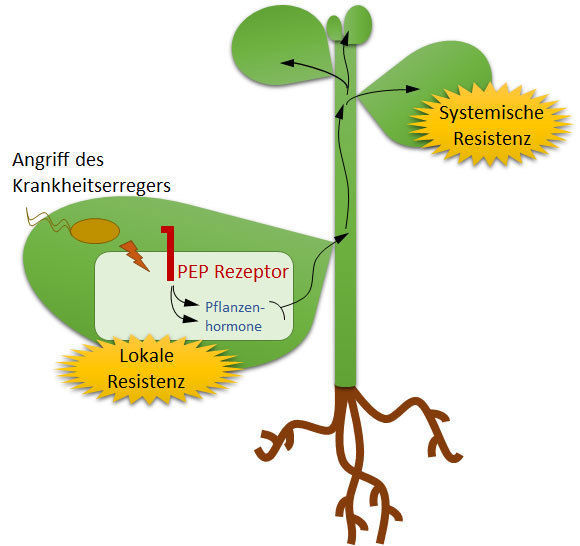
Nach dem Angriff eines Krankheitserregers schicken die infizierten Zellen einen molekularen Laufburschen auf den Weg, der die Pflanze darauf vorbereitet, dass sie sich vielleicht bald überall wehren muss.
© MPI f. Pflanzenzüchtungsforschung/ Annegret Roß
Pflanzen erkennen einen Angreifer zuerst an seiner Fremdheit. Sie besitzen auf den Außenseiten ihrer Zellen Rezeptoren, die wie Häscher nach unbekannten Molekülen fahnden. Wird etwas erkannt, was auf einen potenziellen Angreifer schließen lässt, lösen die Zellen sofort lokale Abwehrreaktionen aus und bereiten sich mit einer systemischen Resistenz auf einen pflanzenweiten Angriff vor. Man kennt die Krisenmanager und Komponenten dieser Mobilisierung. Man weiß auch, dass Pflanzenhormone wie das Ethylen und die Salizyl- und Jasmonsäure an der Organisation der systemischen Resistenz beteiligt sind, aber viele molekulare Details sind noch unbekannt. Annegret Roß aus der Abteilung von Paul Schulze-Lefert und ihre Kollegen haben jetzt einen weiteren Mitspieler bei der Organisation der systemischen Resistenz identifiziert.
Dieser Mitspieler sitzt auf der Außenseite der Zelle und hat eine ähnliche Struktur wie die Rezeptoren, die nach fremden Molekülen fahnden. Allerdings erkennt er keine Krankheitserreger, sondern kleine pflanzeneigene Eiweißfragmente, die wahrscheinlich bei der Verwundung aus einer größeren Vorstufe herausgeschlagen werden. Wie diese Fragmente dann zwischen Zellmembran und Zellwand gelangen, wissen Roß und ihre Kollegen derzeit noch nicht. Vermutlich driften sie über ein Leck in der Zellmembran nach draußen. Dort binden sie an den sogenannten Pep-Rezeptor. Die Wissenschaftler wollten zunächst wissen, was im Zellkern passiert, wenn der Pep-Rezeptor ein entsprechendes Fragment erkannt hat. Für die Organisation einer systemischen Resistenz muss die infizierte Zelle nämlich ihr genetisches Programm umstellen. Sie kann auch auf Gen-Ebene nicht einfach so weitermachen wie bisher, sondern muss das Programm umsetzen, das für die systemische Resistenz notwendig ist.
Die Wissenschaftler um Roß und Saijo konnten zeigen, dass nach der Bindung eines Eiweißfragmentes an den Pep-Rezeptor Hunderte von Genen anders abgelesen werden. Viele dieser Gene mit verändertem Ablese-Verhalten haben auch mit dem Zuständigkeitsbereich der Pflanzenhormone zu tun. Das zeigt, dass diese Signalwege bei der Organisation der systemischen Resistenz eng zusammenarbeiten. Allerdings funktioniert der Signalweg des Pep-Rezeptors auch dann, wenn die Signalwege von Ethylen, Salicyl- und Jasmonsäure durch gezielte Manipulationen ausgeschaltet werden. Der Signalweg des Pep-Rezeptors kann also sehr variabel arbeiten.
Um seine Rolle besser zu verstehen, haben Roß und ihre Kollegen Arabidopsis-Pflanzen ohne Pep-Rezeptor erzeugt. „Wir haben zuerst die bodennahen Blätter infiziert. Gegen diese Infektion konnte sich die pflanzliche Zelle ohne Probleme wehren. Die Immunabwehr vor Ort war also nicht beeinträchtigt“, erklärt Roß ihre Ergebnisse. „Wenn wir dann aber auch die höher gelegenen Blätter infiziert haben, konnte die Pflanze keine systemischen Abwehrreaktionen organisieren. Sie hatte also ohne den Pep-Rezeptor keine systemische Resistenz entwickelt. Sie war ohne Pep-Rezeptor bei der Folgeattacke so anfällig wie bei der Erstinfektion.“ Roß und ihre Kollegen schließen daraus, dass der Pep-Rezeptor am Aufbau der systemischen Resistenz beteiligt und in dieser Rolle auch unentbehrlich ist.
Was machen der Pep-Rezeptor und sein Signalweg nun ganz genau? Die Wissenschaftler konnten zeigen, dass der Signalweg nur in der infizierten Zelle anspringt, nicht in den entfernt gelegenen Blättern. Das spricht dafür, dass er die anderen Ebenen über einen molekularen Boten informiert. Dieser Bote wird vermutlich in das Gefäßsystem der Pflanze entlassen, also in die Röhren, in denen die Pflanzen Wasser und Fotosynthese-Produkte transportieren. Wie dieser Bote aussieht und welche molekularen Eigenschaften er hat, können Roß und ihre Kollegen derzeit noch nicht sagen. Der Bote lässt sich anscheinend auch dadurch mobilisieren, dass die Blätter nur mit den pflanzeneigenen Eiweißfragmenten behandelt werden. Ein Krankheitserreger ist dann gar nicht mehr notwendig. Die Fragmente genügen also schon, um eine systemische Resistenz auszulösen.
Originalveröffentlichung
Annegret Ross et al.; The Arabidopsis PEPR pathway couples local and systemic plant immunity; EMBO Journal























































