Unbeständige Proteine: Neue Einsichten in Transportmechanismus
Die äussere Hülle von Bakterien enthält viele Proteine, die feinste Poren bilden. Sie sind wichtig für die Aufnahme von Nährstoffen und die Übermittlung von Signalen in das Innere der Zelle. Die Gruppe von Sebastian Hiller, Professor für Strukturbiologie am Biozentrum der Universität Basel, zeigt nun erstmals in atomarer Auflösung, dass diese Membranproteine in einem unstrukturierten, sich ständig ändernden Zustand zur äusseren Bakterienhülle transportiert werden. Die wegweisende Studie ist in der Fachzeitschrift «Nature Structural and Molecular Biology» erschienen.
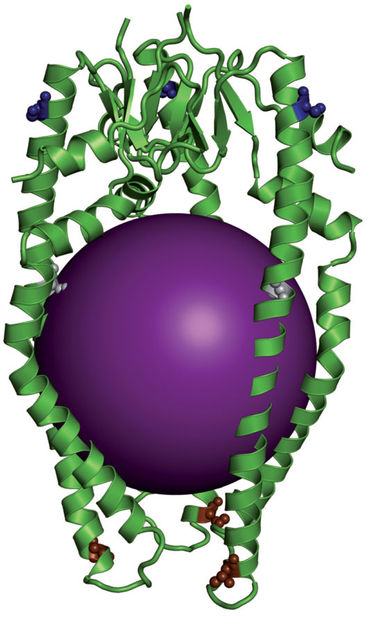
Struktur des Skp-Membranprotein-Komplexes im Modell: Grün: Protein Skp; Violett: kugelförmiges Gebilde kennzeichnet die Position des Membranproteins).
Universität Basel
Die Zellhülle von Bakterien ist eine natürliche Barriere zur Umgebung und gleichzeitig das Tor zur Welt. Gram-negative Bakterien umhüllen sich mit zwei Membranschichten. Mit der Umwelt kommunizieren sie über Proteine, die in der äusseren Zellmembran verankert sind und feinste Poren bilden. Wie genau diese Membranproteine an ihren Bestimmungsort gelangen, beobachteten die Forscher um Prof. Sebastian Hiller vom Biozentrum der Universität Basel nun erstmals auf atomarer Ebene im Bakterium Escherichia coli.
Molekulare «Fähre» sorgt für sicheren Proteintransport
Neue Proteine entstehen in den Proteinfabriken im Inneren der Zelle. Damit die Proteine für die äussere Membran jedoch unbeschädigt den wässrigen Raum zwischen den beiden Membranen überwinden können, braucht es eine molekulare «Fähre». Eine solche Fähre stellt das Protein Skp dar. Wie über einen Fluss transportiert es die noch nicht gefalteten Proteine von einer Seite zur anderen. Dort erst erhalten sie ihre dreidimensionale Struktur und werden in die äussere Membran eingebaut.
Die aktuelle Studie gewährt einen aussergewöhnlichen und tiefen Einblick in den Transportmechanismus. So wird das zu befördernde Membranprotein locker in die feste Struktur des Skp eingebettet. Dabei nimmt es selbst jedoch keine definierte räumliche Struktur ein. «Ganz im Gegenteil, das ungefaltete Protein verändert seinen Zustand ständig – in weniger als einer Tausendstelsekunde und mehr als zehn Millionen Mal während der Überfahrt», erläutert Hiller. «Nur mithilfe der modernen Kernspinresonanzspektroskopie war es uns möglich, diese extrem dynamische Wechselwirkung mit Skp nachzuweisen.» Der Transport in diesem unbeständigen Zustand benötigt keine Energie und ermöglicht eine schnelle Freigabe des beförderten Proteins am Zielort.
Dynamischer Transport als generelles Prinzip
Obwohl die Struktur von Skp schon seit Längerem bekannt ist, zeigt die aktuelle Studie, dass die Dynamik des Skp-Membranprotein-Komplexes für die Entstehung der äusseren Membranproteine wichtig ist. Mit der atomaren Auflösung dieses Komplexes konnten Hiller und sein Team zudem ein generelles Prinzip aufdecken, wie Membranproteine energieunabhängig transportiert werden. Zukünftig möchten sich die Wissenschaftler weitere Proteine, die an dem Transport- und Faltungsprozess beteiligt sind, näher anschauen.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!