Wie Bakterien Transporter in ihre äussere Membran einbauen
Anzeigen
Die äussere Hülle von Bakterien ist von unzähligen Proteinen durchsetzt. Sie bilden kleine Poren und ermöglichen so den Transport von Nährstoffen, Giften und Signalmolekülen. Wie diese Transportproteine in die Membran gelangen, zeigen nun erstmals Prof. Timm Maier und Prof. Sebastian Hiller vom Biozentrum der Universität Basel. Sie klärten mittels Röntgenstrukturanalyse die Struktur-Funktionsbeziehung des Proteins TamA auf, das eine zentrale Rolle bei der Integration von Transportproteinen in die Membran spielt.
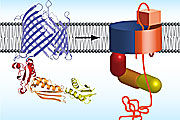
Möglicher Mechanismus, wie Bakterien Autotransporter in ihre äussere Membran einbauen. Links: TamA-Proteinstruktur, rechts: TamA mit Autotransporter (orange).
Universität Basel
Für bestimmte (gramnegative) Bakterien ist es gar nicht so einfach, Proteine vom Inneren der Zelle nach aussen zu schleusen. Denn zusätzlich zur inneren Membran schützt sie eine äussere Hülle vor widrigen Bedingungen. Diese Barriere können die Bakterien überwinden, indem sie spezielle Transportproteine in die Schutzhülle einbauen. Wie das im Detail geschehen kann, konnten Maier und Hiller, Professoren für Strukturbiologie am Biozentrum der Universität Basel, nun gemeinsam aufklären. .
Struktur von Faltungshelfer TamA erklärt seine Funktion
Eine Möglichkeit, Proteine zu befördern, bieten sogenannte Autotransporter. Dabei handelt es sich um Membranproteine, die eine Fassstruktur mit einer Pore bilden, durch die sich die Proteine hinausfädeln können. Für die Faltung und den Einbau von Autotransportern in die äussere Hülle wird jedoch die Hilfe eines weiteren Proteins benötigt. Mittels Röntgenkristallografie entschlüsselten die Autoren der Studie die atomare Struktur des Einbauprotein TamA aus dem Darmbakterium Escherichia coli.
«Das Protein TamA», erklärt Fabian Gruss, Werner-Siemens-Stipendiat und Erstautor, «bildet ebenfalls ein Fass mit einer Pore. Die Pore ist mit einem Deckel nach aussen hin verschlossen, doch die Seitenwand ist einen Spalt weit geöffnet.» Wird der noch ungefaltete Autotransporter angeliefert, angelt sich TamA ein Ende der Aminosäurekette und integriert sie nach und nach durch den Spalt in der Seitenwand in seine eigene Fassstruktur. Dabei weitet sich das Fass, die Pore wird grösser und eine Öffnung nach aussen entsteht. Durch diese gelangt das Transportgut an die Bakterienoberfläche. Die Ablösung des Autotransporters von TamA beendet den Einbauprozess. «Der Autotransportermechanismus war bis jetzt völlig unklar – mit der Struktur von TamA sehen wir zum ersten Mal, wie der Einbau funktionieren könnte.»
Einbauprozess bei Infektionen wichtig
Zahlreiche Krankheitserreger wie Durchfall verursachende Yersinien, Salmonellen oder der Cholera-Erreger gehören zur Gruppe der gramnegativen Bakterien. Sie setzen mit Hilfe von Autotransportern Gifte oder klebrige Proteine frei, mit denen sie ihre Wirtszellen infizieren. In ihrer Studie konnten Maier und Hiller nun ganz neue Erkenntnisse über den Einbau von Autotransporter-Membranproteinen sowie den Transport ihrer Fracht liefern.
Originalveröffentlichung
Fabian Gruss, Franziska Zähringer, Roman P. Jakob, Björn M. Burmann, Sebastian Hiller, Timm Maier. The structural basis of autotransporter translocation by TamA. Nature Structural and Molecular Biology, Published online 23 September 2013