Kopf im Käfig
Fettsäurezusammensetzung von Diacylglycerinen bestimmt lokale Signalmuster
Anzeigen
Im menschlichen Körper dienen Lipide nicht nur als Energiespeicher und Strukturelemente, sie sind auch wichtige Signalmoleküle. Störungen der Lipid-Signalübertragung scheinen an Krankheiten wie Atherosklerose und Diabetes, Entzündungen und Schmerzen beteiligt zu sein. Heidelberger Forscher berichten in der Zeitschrift Angewandte Chemie nun über photoaktivierbare Lipide, mit deren Hilfe sie Signalvorgänge in Zellen räumlich und zeitlich aufgelöst beeinflussen konnten.
Um untereinander zu kommunizieren und auf äußere Reize reagieren zu können, brauchen Zellen Signalübertragungsmechanismen. Die beteiligten Signalkaskaden sind sehr komplex und variieren deutlich von Zelltyp zu Zelltyp. Ein Kaskadentyp läuft beispielsweise über die Aktivierung der Phospholipase C, welche dann einen Membranbaustein in Inosittrisphosphat und das Lipid Diacylglycerin (DAG) spaltet, die nun ihrerseits als sekundäre Botenstoffe innerhalb der Zelle aktiv werden. DAG verankert das Enzym Protein Kinase C (PKC) an der Zellmembran und aktiviert sie. Zudem kann DAG bestimmte Calciumkanäle der Zellmembran öffnen, Calciumionen strömen in die Zelle ein. Dies führt über weitere Stufen der Kaskade zur physiologischen Antwort, etwa einer Veränderung der Genexpression.
Lipide als sekundäre Botenstoffe sind bisher jedoch relativ wenig erforscht. Lipide bestehen aus einer Kopfgruppe und Kohlenwasserstoffketten als „Schwänzen“, die sehr verschieden sein können, was ihre Länge sowie die Anzahl, Verteilung und Anordnung ihrer Doppelbindungen angeht. Bisherige Untersuchungen konnten die Wirkungen verschiedener Schwänze nicht differenzieren, nur die verschiedener Kopfgruppen.
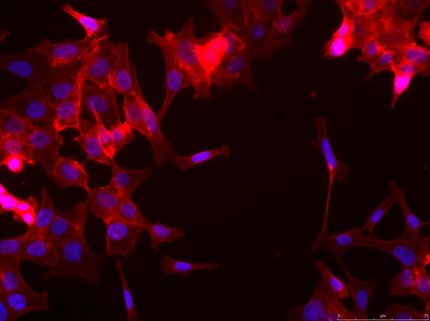
Carsten Schultz und ein Team vom European Molecular Biology Laboratory (EMBL) in Heidelberg nahmen diese Herausforderung jetzt an. Sie stellten DAG-Lipide mit verschiedenen Schwänzen her, deren Glycerin-Köpfe sie in einen „Käfig“ packten, d.h. ein Molekül wird so angeknüpft, dass es die Kopfgruppe blockiert und damit inaktiviert. Die Käfige enthalten eine „Sollbruchstelle“, die bei Bestrahlung mit Licht aufbricht, das DAG wird wieder frei. Mit derartigen photoaktivierbaren Verbindungen gelingt es, biologisch aktive Signalmoleküle räumlich und zeitlich mit subzellulärer Auflösung freizusetzen.
Mit ihren Experimenten konnten die Forscher zeigen, dass die Aktivierung der PKC durch DAG räumlich begrenzt bleibt, während die Erhöhung der internen Calciumionenkonzentration durch Aktivieren von Calciumkanälen die gesamte Zelle erreicht. Überraschenderweise scheinen diese Effekte von der Fettsäurezusammensetzung des Lipids abzuhängen. So induzierte eine der DAG-Varianten weniger, kürzere und schwächere Erhöhungen des Calciumspiegels, eine andere stärkere, lang anhaltende Calcium-Signale, eine dritte hatte dagegen keinen signifikanten Einfluss auf die intrazelluläre Calciumkonzentration.
„Unsere Ergebnisse belegen, dass Zellen auf einen gegebenen Stimulus gleichzeitig mit lokalen und globalen Antworten reagieren können“, so Schultz. „Lokale Signalübertragung ist insbesondere in polarisierten oder sich bewegenden Zellen wichtig, weil hier verschiedene Signale an den entgegengesetzten Seiten der Zelle notwendig sind.“