Multiple Sklerose: Wo und wann lösen Immunzellen im Gehirn eine Autoimmunerkrankung aus?
Gleich mehreren bisher ungeklärten Details im Krankheitsgeschehen der Multiple Sklerose (MS) sind Wissenschaftler der Abteilung Neuroimmunologie und des von der Hertie-Stiftung geförderten Instituts für Multiple Sklerose Forschung (IMSF) der Universitätsmedizin Göttingen (UMG) mit einer neuen Technik auf die Spur gekommen. Mit Hilfe von Leuchteiweißen konnte das Forscherteam unter Leitung von Prof. Dr. Alexander Flügel erstmals in einem Modell für MS einzelne Schritte in den Abläufen sichtbar machen, die die zerstörerische Autoimmunerkrankung im Gehirn auslösen. Bisher ungeklärte Fragen zum autoimmunologischen Geschehen und zu den krankmachenden Immunzellen ließen sich auf diese Weise am lebenden Objekt beobachten und aufklären.
Universitätsmedizin Göttingen
Universitätsmedizin Göttingen
Universitätsmedizin Göttingen
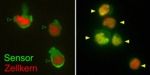
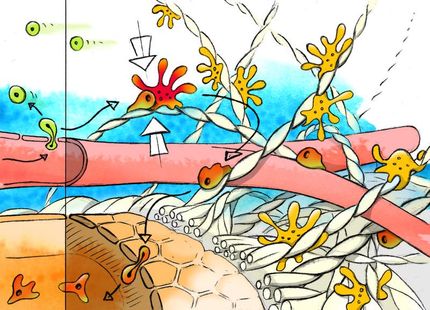
Autoimmunerkrankungen werden durch bestimmte Immunzellen, sogenannte T-Lymphozyten, ausgelöst, die sich gegen das eigene Gewebe richten. Bei der Multiplen Sklerose (MS), einer Autoimmunerkrankung des Zentralnervensystems, dringen T-Lymphozyten in das Gehirn ein. Sie verursachen dort Entzündungsreaktionen, die mit schweren und zum Teil bleibenden Ausfallserscheinungen, z.B. Lähmungen und Gefühlsstörungen, einhergehen können.
Bekannt war bisher: Um ihr selbstzerstörerisches Werk im Gehirn von MS-Patienten ausüben zu können, brauchen T-Lymphozyten unbedingt Hilfe. Offenbar verraten Zellen des Zentralnervensystems wichtige Informationen zur Identität des Hirngewebes. Von allein können T-Lymphozyten das Hirngewebe nicht erkennen.
Auch der grobe Ablauf war bekannt: Ahnungslose Helferzellen präsentieren den „unwissenden“ T-Lymphozyten Bruchstücke von Hirngewebseiweißen auf spezialisierten Trägereiweißen, den sogenannten MHC-Molekülen. T-Lymphozyten können die Bruchstücke mit ihren Spezialantennen ertasten und lernen auf diese Weise Hirngewebe zu erkennen. Dieses Erkennen von Hirngewebe ist letztlich der entscheidende Auslöser für die Autoimmunerkrankung. Die Immunzellen sind nun aktiviert und werfen in Folge ein Alarmprogramm an, das in der Freisetzung von nervenschädigenden Boten- und Abwehrstoffen mündet.
Unklar war bisher: Welche Zellen des Nervensystems leisten diese fatale Hilfe? Wo im Hirngewebe findet die Aktivierung genau statt? In welcher Phase der Hirngewebsentzündung sind diese Prozesse des Erkennens überhaupt für die Ausprägung der Krankheit von Bedeutung?
Alarmanlagen für das Gehirn
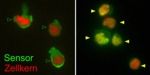
Mitarbeiter der Abteilung Neuroimmunologie und des Instituts für Multiple-Sklerose-Forschung (IMSF) unter der Leitung von Prof. Dr. Alexander Flügel haben ein biologisches Signalsystem entwickelt, mit dem sie diesen Fragen direkt im lebenden Nervensystem nachgehen können. Die Wissenschaftler schleusten hierfür verschiedenfarbige Leuchteiweiße in die krankmachenden T-Zellen ein. Die Leuchtsignale weisen bei ruhenden, nicht aktivierten T-Lympho¬zyten ein bestimmtes Verteilungsmuster auf. „Sobald die T-Lymphozyten aber auf ihre Helfer treffen und durch die Erkennung der Gehirnsubstanz aktiviert werden, kommt es rasch zu einer charakteristischen Umverteilung der Leuchtsignale“, sagt Dr. Dmitri Lodygin, Erstautor der Studie. Das neuartige Alarmsystem konnten die Wissenschaftler der Universitätsmedizin Göttingen bei einem Krankheitsmodell der MS erfolgreich testen. Dabei nutzten sie eine spezialisierte Mikroskopietechnik, um die Verteilung der leuchtenden Alarmsignale in den T-Lymphozyten in Echtzeit zu filmen.
„Verräterische Wachposten"
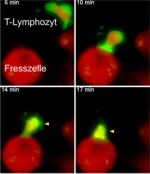
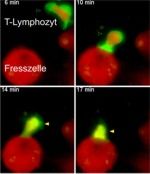
Im gesunden Gewebe des Zentralnervensystems gibt es nicht so viele Zellen, die den T-Lymphozyten bei der Suche nach Hirngewebe helfen könnten. Wie aber kommt der Autoimmunprozess dann in Gang? Diese Frage konnten die Göttinger Wissenschaftler nun mit Hilfe des neuentwickelten Alarmsystems erstmals zweifelsfrei beantworten. Sie fanden heraus, dass die krankmachenden T-Lymphozyten sofort nach dem Verlassen der Blutbahn auf ihre Helfer treffen. Es handelt sich um Fresszellen, sogenannte Makrophagen. Deren eigentliche Aufgabe ist es, das Nervengewebe vor potentiell gefährlichen Eindringlingen zu schützen. Allerdings scheinen diese Fresszellen auch entsorgte Hirneiweiße aufzusammeln und diese den krankmachenden T-Lymphozyten zu zeigen. Die Folge: Die T-Lymphozyten entfalten in den Hirnhäuten eine Entzündungsreaktion, die sich rasch auf das angrenzende Nervengewebe ausweitet.
Kurz, aber herzlich
Ungewöhnliches konnten die Göttinger Forscher beim Filmen der ersten Aktivierungsschritte von T-Lymphozyten beobachten. T-Lymphozyten sind in ihrem Leben nahezu ständig auf Achse, d.h. sie bewegen sich rastlos auf der Suche nach Partnern, die ihnen Aktivierungssignale liefern. Wenn sie schließlich auf diese treffen, stoppen sie und bilden in der Regel eine langdauernde und enge Verbindung mit den Helferzellen. „Die T-Lymphozyten im Nervensystem zeigten allerdings ein völlig anderes Verhalten: Sie machen nur kurz Halt, wenn sie auf ihre Partner treffen, starten ihr Aktivierungsprogramm und setzen dann ihren Weg fort. Nur beim fortgeschrittenen Entzündungsprozess bildeten die T-Lymphozyten auch dauerhafte Kontakte aus“, sagt Dr. Lodygin. Eine spannende Frage bleibt daher für die Forscher: Welche dieser Verbindungen ist für eine vollständige Aktivierung der Lymphozyten verantwortlich? Sind es die kurzzeitigen, die langdauernden, oder gar eine Kombination aus beiden Verbindungen?
Wer den Anfängen nicht wehrt
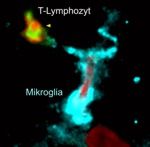
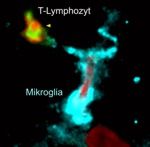
Das Zentralnervensystem kann sich interessanterweise sehr schnell auf eine Entzündungssituation einstellen. Das zeigt sich u.a. daran, dass im entzündeten Gewebe Gehirnzellen plötzlich ganz viele MHC-Moleküle auf ihrer Oberfläche haben können. Das trifft vor allem für die sogenannte Mikroglia zu. Mikrogliazellen sind die „verkappten Immunzellen“ des Zentralnervensystems. Sie sind zahlreich im gesamten Nervengewebe verstreut und können im Entzündungsfall rasch MHC-Moleküle aufbauen: Dadurch sind sie sehr schnell in der Lage, T-Lymphozyten die Eiweißstücke zu präsentieren.
Genau das konnten die Göttinger Forscher beobachten: Die in das Nervengewebe eingedrungenen T-Lymphozyten trafen dort auf Mikroglia und andere Fresszellen, die durch den Entzündungsprozess aus der Blutbahn angelockt worden waren. Viele der T-Lymphozyten zeigten das typische Aktivierungsmuster der Leuchtsignale. „Während der fortgeschrittenen Entzündungsphase findet also auch tief im Nervengewebe eine durch Mikroglia und periphere Fresszellen-vermittelte Lymphozytenaktivierung statt“, sagt Prof. Flügel.
Diese Ergebnisse führten die Forscher zu der entscheidenden Frage: Zu welchem Zeitpunkt muss die T-Lymphozytenaktivierung stattfinden, damit sich eine Autoimmunerkrankung ausbildet? Erstaunlicherweise zeigte sich, dass frühe, noch vor Ausbruch der ersten Krankheitssymptome auftretende Aktivierungsprozesse entscheidend für den Verlauf der Erkrankung waren. „Nach Beginn der Erkrankung konnte zwar die Aktivierung der T-Lymphozyten immer noch gezielt geblockt werden“, so Dr. Lodygin. „Das hatte aber keine Konsequenz mehr für den Krankheitsverlauf.“
Ausblick: Wann muss eingegriffen werden?
Die Beobachtungen des Göttinger Forscherteams könnten auch für die menschliche Erkrankung von Bedeutung sein. Das Blockieren der T-Lymphozyten-aktivierung stellt ein potentielles Ziel therapeutischer Interventionen dar. Die Ergebnisse der Arbeit weisen allerdings darauf hin, dass eine derartige Behandlungsform bei der MS wohl nur dann wirksam sein könnte, wenn sie bereits vor Ausbruch der klinischen Symptome gestartet wird.