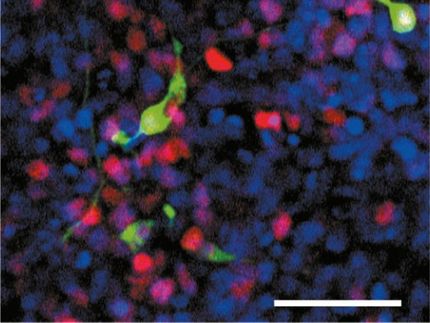
Neue Route für wandernde Proteinpartikel entdeckt
Anzeigen
Ansammlungen von unlöslichen Proteinen führen oftmals zum Tod der betroffenen Zelle. Das Zellsterben wiederum erklärt zum Beispiel das Zittern bei Parkinson oder den Gedächtnisverlust bei Alzheimer. Dass eine mit Proteinaggregaten beladene Zelle ihre Nachbarzellen anstecken kann, zeigt eine Studie von Wissenschaftlern um Ina Vorberg vom Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) in Bonn. In dem im Fachjournal PNAS erschienenen Artikel beschreiben Vorberg und ihr Team eine neue Reiseroute, die die infektiösen Proteinpartikel bei ihrer Wanderschaft von Zelle zu Zelle nehmen.
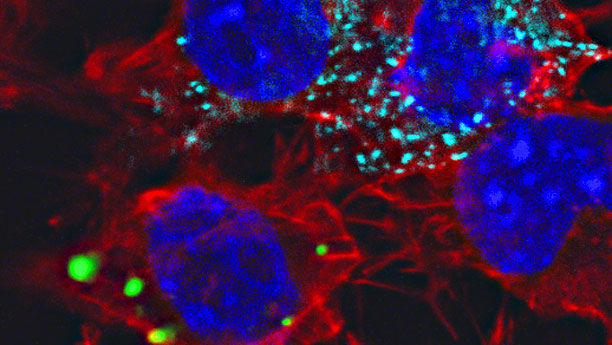
Mikroskopaufnahme von Nervenzellen mit fluoreszierenden Markierungen: Der Kontakt von Zellen, welche Proteinpartikel produzieren (hier türkis), führt in Nachbarzellen ebenfalls zu Ablagerungen desselben Proteins (grün). Die Zellkerne sind blau markiert.
J. Hofmann/DZNE
Zunächst nur als Ursache für BSE ausgemacht, sind Prionen und prionenähnliche Proteine wohl allgemein weiter in der Natur verbreitet als gedacht. Die oft als infektiös bezeichneten Partikel wandeln intakte Proteine in eine defekte Form um – ein sich selbst aufrechterhaltender Prozess beginnt und die deformierten Proteine sammeln sich als Aggregate in den betroffenen Zellen an. Bei Säugetierzellen ist dieser Prozess an Zellmembranen gebunden. Das gilt insbesondere für die sogenannten echten Prionen, die für übertragbare spongiforme Enzephalopathien (TSE) wie Scrapie (Traberkrankheit) bei Schafen und Ziegen, BSE bei Rindern oder der Creutzfeldt-Jakob-Krankheit bei Menschen verantwortlich sind.
Aber auch bei neurodegenerativen Erkrankungen wie Morbus Alzheimer und Morbus Parkinson spielen diese verklumpenden Proteine eine entscheidende Rolle. Bei Alzheimer finden sich Aggregate des Peptids Amyloid beta außerhalb der Zellmembran und Aggregate von Tau-Proteinen im Inneren der Zelle. Bei Parkinson entstehen die unlöslichen Ansammlungen des Proteins alpha-Synuclein ebenfalls im Zytoplasma. Forscher aus Bonn, Bayreuth und München haben nun gemeinsam mit US-Forschern gezeigt, dass eine Übertragung solcher infektiöser Proteinpartikel von Zelle zu Zelle auch dann möglich ist, wenn diese nur im Zellinneren vorkommen. Ina Vorberg erläutert, warum nun ein Umdenken einsetzen wird: „Wir haben experimentell bewiesen, dass bestimmte Proteinpartikel, die aus dem Zytoplasma von Säugetierzellen stammen, sich vermehren und von Zelle zu Zelle ausbreiten können. Demnach gibt es bei Säugetieren Mechanismen, die eine solche Kettenreaktion grundsätzlich auslösen können. Was wir hier im Modell gezeigt haben, könnte daher in ähnlicher Form bei Alzheimer und Parkinson stattfinden.“
Nervenzellen der Maus, Proteine der Hefe
Die Wissenschaftler verwendeten als Modellsystem kultivierte Nervenzellen, die ursprünglich aus der Maus stammten. In diese Zellen schleusten sie den Bauplan eines Modellproteins ein, wodurch sie die Produktion des Proteinmoleküls gezielt steuern konnten. Ausgewählt wurde ein bestimmtes Hefeprotein, das in seiner natürlichen Umgebung – der Hefezelle – in der Lage ist, sich zu großen Aggregaten zusammenzulagern. Außerdem vermehren sich diese Aggregate innerhalb der Zelle. „Zunächst stellten unsere Mauszellen das Protein zwar her, aber es bildeten sich keine Aggregate“, berichtet Vorberg. „Dies änderte sich jedoch, wenn wir Proteinaggregate desselben Proteins von außen zugaben. Plötzlich begann unser lösliches Protein in der Zelle zu verklumpen.“ War diese Reaktion einmal ausgelöst, produzierten die Zellen kontinuierlich neue Klumpen. Und nicht nur das: Auch benachbarte Zellen fingen an, solche Aggregate zu bilden.
Nur die Nachbarn betroffen
Vorberg und ihr Team untersuchten daraufhin, wie eine solche Übertragung erfolgt. Wie sich herausstellte, war der Transfer am effektivsten, wenn die Zellen direkt aneinander grenzten. Die Neurowissenschaftlerin vermutet, „dass eine Zelle Fortsätze ausbildet und die Aggregate über diese Verbindung von einer Zelle zur nächsten gelangen.“
Für die Erforschung der Krankheiten sind diese Erkenntnisse von großer Bedeutung. „Es ist wichtig zu wissen, wie sich Proteinpartikel verbreiten“, betont Vorberg. „Krankheitsrelevante Proteinpartikel könnten sich in ähnlicher Weise ausbreiten, wie das Modellprotein, das wir untersucht haben.“ Die gewonnenen Einblicke in den Mechanismus der Übertragung von einer Zelle zur nächsten könnten neue Behandlungsmethoden erschließen. „Finden wir einen Weg, um die Ausbreitung krankheitsrelevanter Proteinklumpen zu verhindern, dann könnten wir möglicherweise auf das Voranschreiten der Erkrankung einwirken“, so Vorberg.