Bösartige Hirntumoren: Neue Strategien zur Überwindung der Therapieresistenz
Anzeigen
Wissenschaftler des Instituts für Neuropathologie in Düsseldorf und der Klinik für Neurologie in Zürich untersuchen die Mechanismen der Resistenz bösartiger Hirntumoren (Glioblastome) gegenüber Strahlentherapie und Chemotherapie. Sie konzentrieren sich hier speziell auf eine erst vor wenigen Jahren als bedeutsam erkannte Gruppe von kleinen Nukleinsäuremolekülen (microRNA), die als wesentliche Regulatoren genetischer Prozesse erkannt wurden. Durch Beeinflussung der relativen Mengen dieser Signalmoleküle soll das Ansprechen bösartiger Hirntumoren auf die klassischen Tumortherapien deutlich verbessert werden.
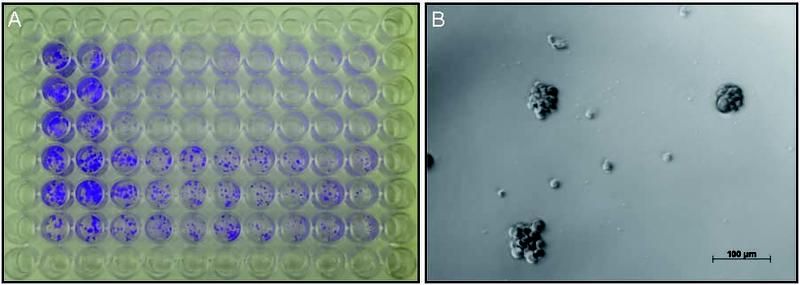
A) Hirntumorzellen mit induzierter Resistenz gegenüber Chemotherapie (untere Plattenhälfte) weisen gegenüber ursprünglichen Hirntumorzellen (obere Plattenhälfte) ein deutlich höheres Resistenzniveau gegenüber Temozolomid (von links nach rechts in aufsteigenden Konzentrationen) auf und dienen als Modell für die Erforschung von Resistenzmechanismen im Patienten. B) Tumorstammzellen (ZH-161) in Zellkulturmedium.
Caroline Happold; Nina Stojceva; Zürich
Die mittlere Überlebenszeit für Patienten mit Glioblastomen, einer besonders aggressiven und häufigen Hirntumorform, beträgt immer noch weniger als ein Jahr. Das Ansprechen auf die weitere Therapie nach der Operation, Strahlentherapie und Chemotherapie, ist sehr unterschiedlich: Manche Tumoren zeigen sich primär resistent und wachsen trotz dieser Therapie weiter. Andere Tumoren bleiben über Monate inaktiv, entwickeln aber dann im Verlauf Resistenzmechanismen.
Die Resistenz von Glioblastomzellen gegenüber Chemotherapie und Strahlentherapie wird unter anderem durch das Repertoire an Genen beeinflusst, die in den Tumorzellen aktiv sind. Viele dieser Gene sorgen dafür, dass die Erbinformation (DNA) in den Tumorzellen unbeschadet bleibt. Das Aktivitätsniveau der Gene wiederum wird durch ein komplexes Netzwerk von microRNA-Molekülen reguliert. Die Wissenschaftler in Düsseldorf und Zürich haben solche microRNA-Moleküle identifiziert, die vermehrt von therapieresistenten Tumorzellen gebildet werden.
Ziel eines von der Wilhelm Sander-Stiftung geförderten Projektes ist es nun zu untersuchen, warum diese Moleküle verstärkt gebildet werden und wie man der vermehrten Bildung dieser Moleküle entgegen wirken könnte. Außerdem wollen die Teams um Prof. Dr. Michael Weller und Prof. Dr. Guido Reifenberger klären, ob eine therapeutische Beeinflussung dieser Moleküle geeignet ist, resistente Tumoren für Chemotherapie und Strahlentherapie empfindlich zu machen. Bei diesem Vorhaben kommen modernste Verfahren der Hochdurchsatztechnologie zum Einsatz. Das therapeutische Potenzial dieses Therapieansatzes soll anschließend in relevanten Mausmodellen bösartiger Hirntumoren überprüft werden.
Konkret werden im Rahmen des geförderten Projektes Gliomstammzellen mittels wiederholter Behandlung mit Temozolomid, dem Chemotherapeutikum, das als Standard in der Hirntumortherapie eingesetzt wird, resistent gemacht, um so ein Abbild der Abläufe im Patienten in die Zellkultur zu übertragen. Die so generierten resistenten Stammzelllinien werden mittels „Mikroarray“-Analysen auf die Aktivität von mehr als 1000 verschiedenen microRNA hin analysiert, um diejenigen microRNA zu identifizieren, die sich im Rahmen einer Resistenzentwicklung im Vergleich zu den nicht-resistenten Zellen unterschiedlich reguliert zeigen. Die so identifizierten Moleküle werden im Rahmen weiterer Analysen untersucht und ihre Rolle für die Aktivität spezifischer Zielgene validiert. In einem parallelen Ansatz wird das Expressionsprofil von microRNA im Tumorgewebe von Patienten mit unbehandelten Glioblastomen zum Zeitpunkt der ersten Operation und im Verlauf zum Zeitpunkt der Operation eines Rezidivtumors nach Strahlen- und Chemotherapie analysiert. Die entsprechenden Ergebnisse werden mit den Untersuchungen in der Zellkultur abgeglichen. Abschliessend werden die Ergebnisse der Zellkultur- und Gewebeuntersuchungen in einem Mausmodell überprüft. Die Kandidatenmoleküle, die als Therapieresistenz-fördernd identifiziert werden, sollen dann auf ihre Rolle als neue Marker für das Ansprechen von Glioblastompatienten auf eine Chemotherapie hin analysiert werden. Desweiteren wird die Möglichkeit ihrer spezifischen Hemmung oder Aktivierung geprüft, um erste Hinweise auf mögliche neue Behandlungsansätze zu erzielen.