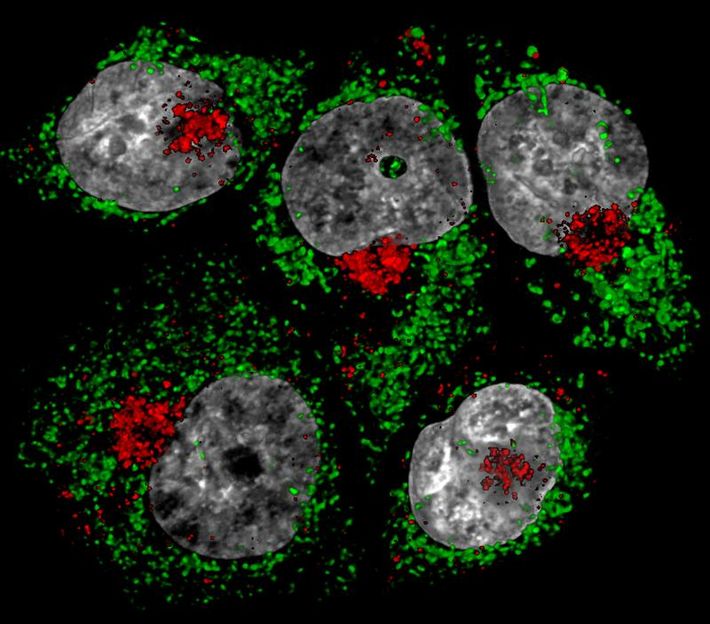
Herzerkrankungen auf der Spur: Genetische Defekte erhöhen Cholesterin-Spiegel
Anzeigen
Wissenschaftler des Universitätsklinikums Heidelberg und des European Molecular Biology Laboratory (EMBL) haben mit Hilfe eines neuen Analyseverfahrens 55 Gene identifiziert, die den Cholesterin-Spiegel beeinflussen. Die Gene liegen in Abschnitten der Erbinformation, die – falls fehlerhaft – mit einem erhöhten Risiko für Herz-Kreislauferkrankungen in Verbindung gebracht werden. Ein hoher Cholesterinspiegel im Blut ist einer der wichtigsten Risikofaktoren für Gefäßverkalkung und Herzinfarkt; über welche Mechanismen er reguliert wird, ist allerdings noch wenig erforscht. Nun sollen weitere Untersuchungen zeigen, welche Rolle die neu entdeckten Gene bei der Cholesterin-Regulation spielen und ob sie sich therapeutisch nutzen lassen. Das innovative mikroskop-basierte Verfahren eignet sich zur Erforschung der molekularen Ursachen jeder Erkrankung, die – wie die gestörte Aufnahme von Cholesterin – mit sichtbaren Veränderungen der Zellfunktion einhergeht.
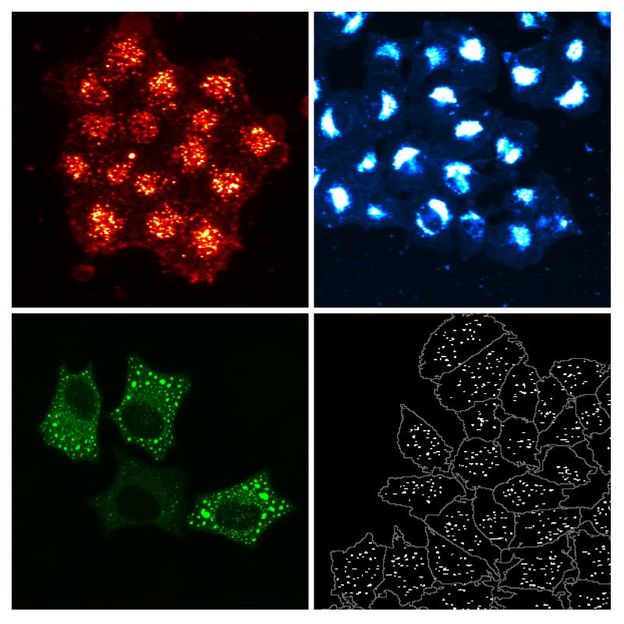
Hochauflösende Fluoreszenz-Mikroskopie zur Identifizierung neuer Cholesterin-regulierender Gene: Oben links: Cholesterinaufnahme (orange) in die Zellen; oben rechts: freies Cholesterin (blau) in den Zellen; unten links: Lokalisation eines neuen Cholesterin-regulierenden Proteins (grün); unten rechts: Zellmasse (grau), aufgenommene Cholesterin-Partikel (weiß).
PLoS Genetics ; Peter Blattmann/EMBL und Christian Schuberth/ Universitätsklinikum Heidelberg.
Die Ausgangsdaten für die Heidelberger Studie lieferten sogenannte Genomweite Assoziations-Studien (GWAS) zu genetischen Ursachen von Herz-Kreislauferkrankungen: Dazu vergleichen Wissenschaftler das Genom hunderttausender Menschen miteinander und filtern dabei Abschnitte im Erbgut heraus, die z.B. bei Menschen mit erhöhtem Cholesterin-Spiegel, Erkrankungen der Herzkranzgefäße oder Herzinfarkt häufiger verändert sind als bei gesunden Menschen. Bisher wurden mehr als 120 solcher kritischen Bereiche im Erbgut identifiziert.
Neues mikroskop-basiertes Analyseverfahren gibt Hinweise auf Funktion der Gene
Ob diese Veränderungen tatsächlich krankheitsrelevant sind, welche Informationen die Abschnitte enthalten oder in welchen Regelkreisen sie eine Rolle spielen, können Genomweite Assoziationsstudien allerdings nur selten klären. Diese Fragen lassen sich nun mit dem neuen Analyseverfahren zum Teil beantworten, das die Arbeitsgruppen um Dr. Heiko Runz, Institut für Humangenetik des Universitätsklinikums Heidelberg, und Dr. Rainer Pepperkok vom EMBL entwickelt haben. Die Wissenschaftler untersuchten insgesamt 133 Gene in 56 der durch die GWAS mit erhöhtem Herzinfakrtrisiko in Verbindung gebrachten Bereiche genauer.
Dazu blockierte das Team in menschlichen Zellen die Funktion jedes dieser Gene mit Hilfe der sogenannten RNA-Interferenz-Technik: Dabei fangen künstlich hergestellte Moleküle gezielt wichtige Botenstoffe (mRNA) ab, so dass das Zielgen seine Wirkung nicht entfalten kann. Anschließend wurde mittels hochauflösender Mikroskopie und automatisierter Bildverarbeitung erfasst, ob Zellen mit gestörter Genfunktion weniger Fluoreszenz-markiertes Cholesterin aufnahmen oder an unüblicher Stelle ablagerten. Körperzellen nehmen Cholesterin aus dem Blut auf. Ist diese Aufnahme gestört, steigt der Cholesterinspiegel im Blut.
Erstmals können umfangreiche genetische Daten systematisch gefiltert werden
„Mit unserem Verfahren haben wir eine große Anzahl neuer Gene identifiziert, die diesen kritischen Vorgang beeinflussen und wahrscheinlich auch eine entscheidende Rolle bei der Entstehung von Herz-Kreislauferkrankungen spielen“, sagt Dr. Heiko Runz, der derzeit am Center for Human Genetic Research (CHGR) in Boston, USA, forscht. „Nun müssen weitere Studien zeigen, wie genau diese Gene wirken, wie häufig sie in Patienten verändert sind und ob sich Defekte in diesen Genen eventuell mit Medikamenten kompensieren lassen.“
„Mit Hilfe dieses Verfahrens können wir erstmals die umfangreichen Informationen aus genomweiten Assoziationsstudien systematisch aufarbeiten, die Funktion mehrerer Gene parallel und objektiv untersuchen und so die Faktoren herausfiltern, die tatsächlich krankheitsrelevant sind“, so Dr. Rainer Pepperkok.