Was Grünalgen im Dunkeln treiben
RUB-Forscher entschlüsseln kaum bekannten Stoffwechselweg zur Wasserstoffproduktion
Anzeigen
Wie Grünalgen im Dunkeln Wasserstoff herstellen, berichten Biologen der Ruhr-Universität.Damit haben sie einen bislang kaum untersuchten Mechanismus zur Produktion des Gases aufgedeckt; denn üblicherweise interessieren sich Forscher für die lichtgetriebene Wasserstoffsynthese. „Wasserstoff könnte den Menschen aus der Energiekrise helfen“, sagt Prof. Dr. Thomas Happe, Leiter der AG Photobiotechnologie. „Will man Grünalgen zu einer höheren Wasserstoffbildung bringen, ist es wichtig, alle Produktionswege zu verstehen.“
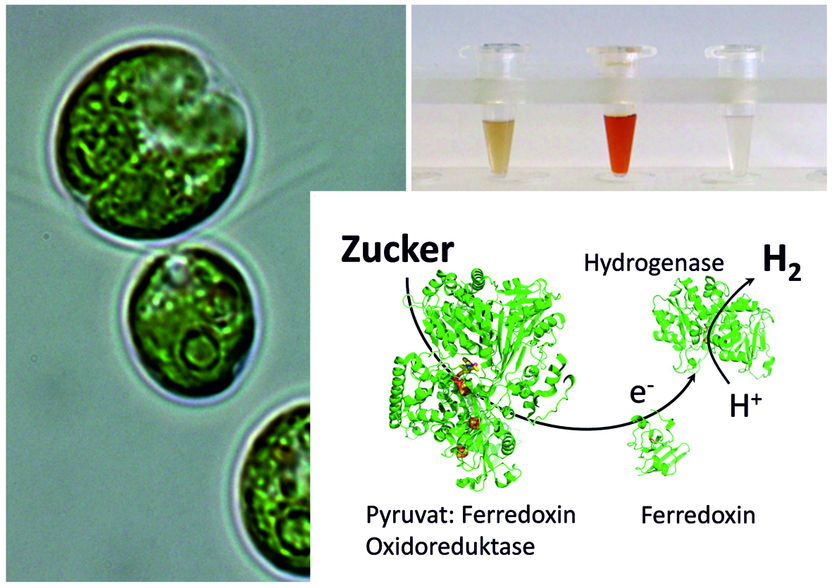
Die einzellige Grünalge Chlamydomonas kann nicht nur mittels Sonnenenergie H2 produzieren, sondern auch im Dunkeln. Die RUB-Forscher deckten die Kombination der verantwortlichen Proteine auf.
© AG Photobiotechnologie, RUB
Unter Stress stellen Grünalgen Wasserstoff her – auch im Dunkeln
Einzellige Grünalgen der Art Chlamydomonas sind mikroskopisch kleine Lebewesen; zehn von ihnen passen nebeneinander auf ein menschliches Haar. In mancher Hinsicht sind die Mikroalgen höheren Pflanzen, etwa Bäumen, gar nicht so unähnlich, sie betreiben zum Beispiel auch Photosynthese. Anders als Landpflanzen können sie Lichtenergie aber auch in die Produktion von molekularem Wasserstoff (H2) stecken. “Chlamydomonas und Co bilden Wasserstoff aber nur unter Stress“, sagt Thomas Happe. „Die Abgabe des energiereichen Gases dient sozusagen als Überlaufventil, damit überschüssige Lichtenergie nicht den empfindlichen Photosyntheseapparat schädigt.“ Chlamydomonas kann aber auch im Dunkeln Wasserstoff herstellen. Diese Tatsache ist seit Jahrzehnten bekannt; trotzdem ist die H2-Synthese ohne Licht kaum untersucht, da dabei sehr viel weniger des Gases entsteht als im Licht. Außerdem ist es kompliziert, das Schlüsselenzym, die sogenannte Pyruvat-Ferredoxin-Oxidoreduktase, in größeren Mengen zu isolieren. Die RUB-Forscher nahmen das Projekt dennoch in Angriff.
Wasserstoffproduktion im Dunkeln im Reagenzglas nachgeahmt
Happes Team stellte den Kern der Dunkelwasserstoffproduktion im Reagenzglas nach und belegte damit den zugrundliegenden Mechanismus. Um an die beteiligten Proteine zu gelangen, ließen die Forscher diese von Bakterien produzieren. Sie brachten zunächst die entsprechenden Gene der Grünalgen in das Darmbakterium Escherichia coli ein, zum Beispiel das Gen für die Pyruvat-Ferredoxin-Oxidoreduktase. Nach dieser Bauanleitung stellte E. coli dann die Proteine her. Happes Team isolierte sie aus den Bakterienzellen und untersuchte sie wie ein Baukastensystem. Im Reagenzglas testeten die Biologen, wie verschiedene Kombinationen von Proteinen unter bestimmten Umweltbedingungen miteinander interagierten.
„Uraltes Enzym“ entdeckt
Dabei fanden sie heraus, dass die Algen bei Stress im Dunkeln auf einen Stoffwechselweg umschalten, der sich sonst nur in Bakterien oder einzelligen Parasiten findet. „Chlamydmonas besitzt ein evolutionär uraltes Enzym“, erklärt Jens Noth aus der AG Photobiotechnologie. „Mit Hilfe von Vitamin B1 und Eisenatomen gewinnt es Energie aus dem Abbau von Zuckern.“ Diese Energie nutzen dann andere Grünalgen-Enzyme, die Hydrogenasen, um Wasserstoff zu bilden. Die Einzeller schalten den Stoffwechselweg ein, wenn sie im Dunkeln plötzlich in sauerstofffreie Bedingungen geraten. Denn wie Menschen brauchen die Grünalgen Sauerstoff zum Atmen, wenn sie ihre Energie nicht aus dem Sonnenlicht schöpfen können. Die Wasserstoffbildung im Dunkeln hilft den Zellen, diese Stressbedingung zu überleben. „Mit dieser Erkenntnis haben wir nun ein weiteres Puzzlestück gefunden, um ein genaues Bild der H2-Produktion in Chlamydomonas zu erhalten“, sagt Thomas Happe. „Das könnte in Zukunft helfen, auch die biotechnologisch relevante lichtabhängige H2-Bildungsrate zu erhöhen.“