Protein-Origami: Schneller falten ist besser
Anzeigen
Die Entwicklungsgeschichte der Proteine zeigt, dass Proteinfaltung ein wichtiger evolutionärer Faktor ist. Vor allem die Faltungsgeschwindigkeit spielt dabei eine große Rolle. Das ergab eine Computeranalyse von Forschern des Heidelberger Instituts für Theoretische Studien (HITS) und der University of Illinois at Urbana-Champaign: Seit fast vier Milliarden Jahren gibt es einen Trend zur schnelleren Faltung. „Der Grund dafür könnte sein, dass die Proteine dadurch weniger anfällig für Verklumpungen sind und ihre Aufgaben früher ausführen können“, sagt Dr. Frauke Gräter (HITS), die die Analyse leitete.
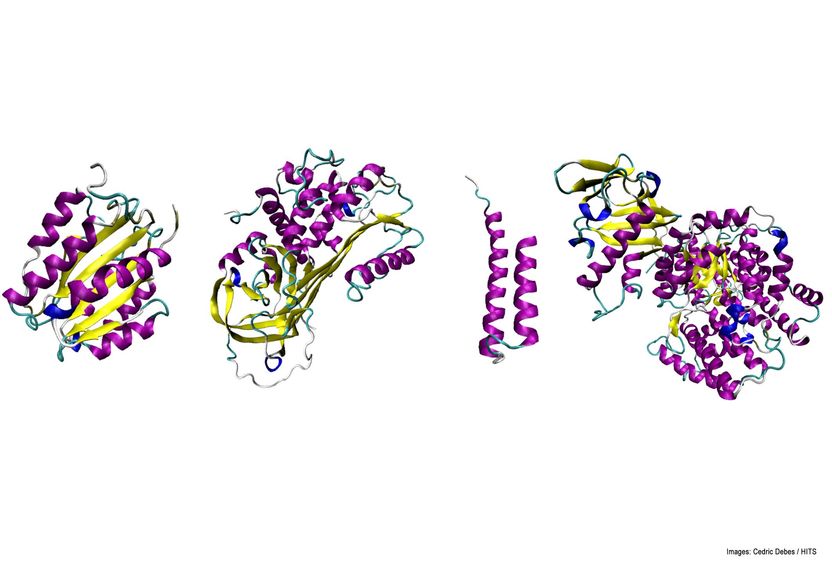
Heute finden sich in der Natur zahlreiche Formen unterschiedlicher Proteinfaltungen. Die meisten dieser Formen haben sich seit dem biologischen „Urknall“ vor 1,5 Millarden Jahren entwickelt. Einen wichtigen Faktor für die Diversifizierung stellte dabei das Faltungstempo dar, wie die Studie herausfand.
Cedric Debes / HITS
Proteine sind elementare Bausteine des Lebens. Sie erfüllen oft lebenswichtige Funktionen. Damit sie aktiv werden können, müssen sich Proteine in dreidimensionale Strukturen falten. Fehlfaltung von Proteinen führt zu Krankheiten wie Alzheimer oder Creutzfeldt-Jakob. Welche Strategien hat die Natur im Laufe der Evolution entwickelt, um die Faltung von Proteinen zu verbessern?
Um dieser Frage nachzugehen, warf die Chemikerin Dr. Frauke Gräter (Heidelberger Institut für Theoretische Studien) einen Blick weit zurück in die Erdgeschichte. Gemeinsam mit ihrem Kollegen Prof. Gustavo Caetano-Anollés von der University of Illinois at Urbana-Champaign untersuchte sie in einer Computeranalyse die Faltungsgeschwindigkeit aller heute bekannter Proteine, die vor bis zu 3,8 Milliarden Jahren entstanden sind. Die Forscher beobachteten dabei einen Trend: Die Geschwindigkeit nahm über einen Großteil des Zeitraums zu, von den Urbakterien bis hin zu den Mehrzellern. Als vor 1,5 Milliarden Jahren komplexere Strukturen auftauchten und einen biologischen „Urknall“ verursachten, entstanden zwar auch Proteinstrukturen, die langsamer falteten. Aber die Tendenz zu mehr Tempo im Protein-Origami ist dominierend, unabhängig von der Länge der Aminosäureketten, die die Proteine bildeten.
„Der Grund für die schnellere Faltung könnte darin liegen, dass die Proteine dadurch weniger anfällig für Verklumpungen sind und ihre Aufgaben früher ausführen können“, sagt Frauke Gräter, Leiterin der HITS-Forschungsgruppe „Molecular Biomechanics“.
Genetik und Biophysik für große Datenmengen
In ihrer Arbeit setzten die Wissenschaftler auf einen interdisziplinären Ansatz, der Genetik mit Biophysik verbindet. „Es ist die erste Analyse, die alle bekannten Proteinstrukturen und Genome mit Faltungsraten als einer physikalischen Größe verbunden hat“, so Frauke Gräter.
92.000 Proteine und 989 Genome enthalten viele Daten, die nur mit rechnerischen Methoden zu bewältigen sind. Gustavo Caetano-Anollés, der in Urbana-Champaign das „Evolutionary Bioinformatics Laboratory“ leitet, klassifizierte alle strukturell bekannten Proteine aus der Protein Database (PDB) nach ihrem Alter. Er spürte Proteinsequenzen in den Genomen auf, die die gleiche Faltung haben wie die einzelnen Proteine, und glich sie miteinander auf einer Zeitskala ab. So kann man erkennen, ab wann welche Proteine zu welchem Organismus gehörten.
Danach fütterte Gräters Mitarbeiter Cedric Debes den Computer mit diesen Daten und erstellte ein mathematisches Modell, um die Faltungsrate der Proteine vorherzusagen. Die einzelnen Schritte der Faltung spielen sich in unterschiedlichen Geschwindigkeiten von Nanosekunden bis hin zu Minuten ab - Zeitunterschiede, die kein Mikroskop oder Laser für so viele Proteine beobachten kann. Auch eine Computersimulation, die alle Faltungen in allen Proteinen berechnet, würde Jahrhunderte Rechenzeit auf einem Großrechner benötigen. Die Forscher arbeiteten deshalb mit einer weniger datenintensive Methode: Die Faltungsgeschwindigkeit der einzelnen Proteine wurde auf der Basis zuvor experimentell ermittelter Strukturen berechnet: Ein Protein faltet immer an den gleichen Punkten. Wenn diese Punkte weit auseinander liegen, braucht es dafür mehr Zeit, als wenn die Punkte nah beisammen sind. Mit der sogenannten „Size-Modified Contact Order“ (SMCO) kann man vorhersagen, wie schnell sich die Punkte zusammenfinden und wie schnell dadurch das Protein faltet, unabhängig von der Länge des Proteins.
„Unsere Ergebnisse zeigen, dass es am Anfang Proteine gab, die nicht besonders gut falten konnten“, resümiert Frauke Gräter. „Die Natur verbesserte im Laufe der Zeit die Proteinfaltung, so dass schließlich komplexere Strukturen wie der Mensch entstehen konnten.“
Schneller und kürzer – im Dienst der Evolution
Auch die Aminosäureketten, die für die Bildung der Proteine verantwortlich sind, verkürzten sich im Laufe der Evolution. Dieser Faktor trug zusätzlich dazu bei, das Tempo der Faltung zu steigern , wie die Studie zeigt.
„Seit es Eukaryoten, also Lebewesen mit Zellkern gibt, steht die Proteinfaltung nicht mehr so sehr im Vordergrund“, sagt Frauke Gräter. Denn die Natur entwickelte seitdem eine komplexe Maschinerie, die missgefaltete Proteine wieder repariert, wie die sogenannten Chaperone. „Es scheint, als ob die Natur eine gewisse Unordnung in Kauf nimmt, um Strukturen zu entwickeln, die sonst nicht entstehen könnten.“
Die Zahl der bekannten Genome und Proteinstrukturen steigt stetig an und vergrößert damit die Datenbasis für weitere Computeranalysen zur Evolution der Proteine. Frauke Gräter: „In künftigen Analysen der Proteinevolution können wir damit vielleicht auch die Frage leichter beantworten, ob Proteine stabiler oder flexibler wurden über die Milliarden Jahre ihrer Entwicklung hinweg.“