Kleine Veränderung, große Wirkung – Halogenbindungen in der Medikamentenforschung
Halogenbindungen werden seit einiger Zeit in der Kristall-Synthese, in der Werkstoffforschung und in der Nanotechnologie eingesetzt. Forscher am Heidelberger Institut für Theoretische Studien (HITS) und an der tschechischen Akademie der Wissenschaften in Prag haben nun ein neues Verfahren zur Anwendung von Halogenbindungen in der Medikamentenforschung entwickelt.
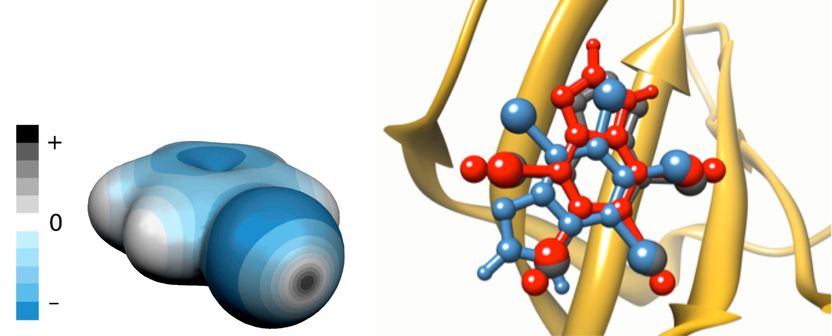
Linke Seite: Ladungsverteilung rund um das Brombenzolmolekül. Regionen mit negativem elektrostatischem Potenzial sind blau markiert, positiv geladene Regionen grau. Die graue Scheibe im Vordergrund markiert das Sigma-Loch. Rechte Seite: Überlagerung der vorhergesagten Bindungsstellen des K17-Inhibitors der Kaseinkinase 2 (PDB-Code 2OXY) mit expliziten Sigma-Löchern (rot) und ohne (blau) und Vergleich mit der Kristallstruktur (grau).
HITS
Halogenchemie wird seit fast 70 Jahren von Medizinchemikern verwendet. Bisher wurden Halogene zur Optimierung sogenannter ADMET-Eigenschaften herangezogen. Halogene verbessern die orale Aufnahme und erleichtern es potenziellen Medikamenten, biologische Barrieren zu passieren. Sie helfen, kleine hydrophobe Hohlräume in vielen Zielproteinen zu füllen, und verlängern die Wirkungsdauer des Arzneimittels. Kurz: Sie machen vielversprechende chemische Verbindungen zu potenziellen Medikamenten. Jedoch wurden Interaktionen, an denen Halogenatome beteiligt sind, in der vorklinischen Medikamentenentwicklung bisher weitgehend vernachlässigt.
Forscher aus den Bereichen Quantenchemie und strukturbasierte Medikamentenentwicklung in Heidelberg und Prag haben nun ein neues Verfahren entwickelt, um Halogenverbindungen in der computergestützten medizinischen Chemie und für Anwendungen in der Medikamentenforschung zu nutzen. An der Studie unter der Leitung von Dr. Agnieszka Bronowska vom Heidelberger Institut für Theoretische Studien (HITS) waren Forscher der Akademie der Wissenschaften der Tschechischen Republik beteiligt.
Die meisten Halogene (außer Fluor) haben einzigartige Eigenschaften, mit denen sie Interaktionen zwischen potenziellen Medikamenten und ihren Zielproteinen stabilisieren können. Diese Eigenschaften sind quantenchemischen Ursprungs: Sie beruhen auf der Anisotropie, also der Richtungsabhängigkeit der Ladungsverteilung um das Halogenatom, wenn es an ein Substrat bindet, das dem Atom Elektronen entzieht. Überraschenderweise haben Halogene trotz negativer Ladung Regionen, die weiterhin eine positive Ladung aufweisen. Diese Regionen werden als Sigma-Löcher bezeichnet und sind für den gerichteten und stabilisierenden Charakter von Halogenbindungen mit anderen elektronegativen Atomen wie Sauerstoff oder Stickstoff verantwortlich.
Wenn Sigma-Löcher bei der Vorhersage der Struktur und der Energetik von Medikament-Proteinkomplexen nicht berücksichtigt werden, kann das zu Fehlern führen, die die Entwicklung eines Medikaments scheitern lassen.
Beim neuen Verfahren werden die positiv geladenen Sigma-Löcher mit einem masselosen, geladenen Pseudo-Atom angenähert. Dieses wird als „explizites Sigma-Loch“ bezeichnet. Dadurch konnten Agnieszka Bronowska und ihre Kollegen einen quantenchemischen Effekt in schnellere (und viel ungenauere) computergestützte Analyseverfahren in der strukturbasierten Medikamentenentwicklung integrieren. „Wir haben fast einhundert Komplexe aus medizinisch relevanten Proteinen und halogenierten Molekülen getestet“, sagt die Forscherin. „Die Ergebnisse zeigten eine signifikante Verbesserung der Beschreibung solcher Komplexe nach der Einführung des expliziten Sigma-Lochs.“
Das neue Verfahren wird bereits von Forschungsgruppen in Tschechien, Großbritannien und den USA eingesetzt, um neuartige Verbindungen zur Behandlung von chemotherapieresistenten Krebsarten, ansteckenden Krankheiten und Alzheimer zu entwickeln.






















































