Proteine verbinden sich wie ein Reißverschluss
Membranproteine sind die „molekularen Maschinen“ in biologischen Zellhüllen. Sie steuern etwa den Stofftransport durch die Membran, die Signalübertragung von Hormonen und die Photosynthese. Dabei spielt ihre Form, also die Faltung der Moleküle, eine entscheidende Rolle, um etwa Poren zu bilden. Forscher des Karlsruher Institutes für Technologie und der Universität Cagliari stellen nun im Fachmagazin Cell vor, wie sich die Proteine dabei eines neuartigen Reißverschlussprinzips bedienen, um Funktionseinheiten zu schaffen.
„Es ist faszinierend zu sehen, welch elegante Grundprinzipen die Natur beim Bau von molekularen Maschinen verwendet“, erklärt Anne Ulrich, Direktorin am Institut für Biologische Grenzflächen des KIT. „Ein ‚Ladungsreißverschluss‘ zwischen geladenen Seitenketten ist ein ganz unerwarteter Mechanismus, wie Membranproteine ihre Ladungen neutralisieren und auf diese Weise hydrophobe Zellmembranen durchspannen können.“
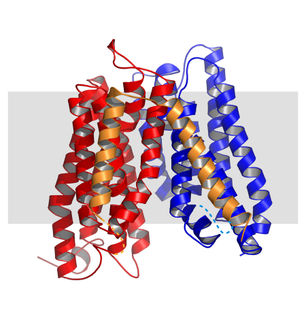
In einer aktuellen Studie untersuchen Ulrich und ihr Team die Twin-Arginine Translocase (Tat), die in der Zellmembran von Bakterien als Export-Maschinerie für gefaltete Proteine dient. Mehrere Exemplare des Bausteins TatA lagern sich zu einer Pore zusammen und können dabei den Durchmesser der Pore flexibel an die zu transportierende Fracht anpassen. „Doch wie baut man eine Pore aus TatA-Proteinen? Wie können sie reversibel ein riesiges Loch in der Membran ausbilden, um den unterschiedlichsten Molekülen den Weg freizumachen, aber ohne dass die Zelle dabei leckschlägt?“, formuliert Ulrich die Ausgangsfragen.
Um das zu klären, haben die Forscher den molekularen Aufbau von TatA im Bakterium B. subtilis untersucht, das aus einer Kette von 70 Aminosäuren besteht. Die Strukturanalyse hat gezeigt, dass sie sich zu einer starren, stäbchenförmigen Helix auffaltet, auf die ein sehr geschmeidiger, langgestreckter Bereich folgt. Viele der Aminosäuren in der Helix und im angrenzenden Bereich tragen negative oder positive Ladungen, die einer Ionenladung entsprechen. „Erstaunlicherweise ist die Reihenfolge der Ladungen auf der Helix komplementär zu denen im angrenzenden Bereich des Proteins. Klappt man das Protein also an der Verbindungsstelle zusammen wie ein Scharnier, treffen immer positive und negative Ladungen aufeinander und ziehen sich an. Das Protein verbindet also seine beiden Bereiche so, wie die Zähne eines Reißverschlusses ineinandergreifen.
„Der Clou ist jedoch, dass dieses Bindungsprinzip auch gegenüber den Nachbarproteinen funktioniert“, erklärt Ulrich. Statt sich also ganz alleine zuzuklappen, geht jedes TatA Protein auch Reißverschlussbindungen mit seinen beiden Nachbarn ein. Wie Computersimulationen zeigen, entstehen dadurch stabile und zugleich flexible Verbindungen zwischen den benachbarten Molekülen. So können sich auf diese Weise beliebig viele Proteine zu einem insgesamt ungeladenen Ring zusammen lagern, der dann die TatA Pore in der hydrophoben Membran auskleidet. Dieses neuartige Reißverschlussprinzip scheint nicht nur beim Proteintransport eine Rolle zu spielen, sondern auch beim Angriff bestimmter antimikrobieller Peptide auf Bakterien, oder bei deren Stressantwort durch Biofilmbildung.
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Polyethersulfone Ultrafilter von Sartorius
Zuverlässige Filtration mit PESU-Membranen
Perfekt für Biotechnologie und Pharma, widersteht Sterilisation und hohen Temperaturen

Hydrosart® Microfilter von Sartorius
Hydrophile Mikrofilter für Bioprozesse
Minimale Proteinadsorption und hohe Durchflussraten

Sartobind® Rapid A von Sartorius
Effiziente Chromatographie mit Einweg-Membranen
Steigern Sie die Produktivität und senken Sie Kosten mit schnellen Zykluszeiten

Sartopore® Platinum von Sartorius
Effiziente Filtration mit minimaler Proteinadsorption
Reduziert Spülvolumen um 95 % und bietet 1 m² Filtrationsfläche pro 10"

Hydrosart® Ultrafilter von Sartorius
Effiziente Ultrafiltration für Biotech und Pharma
Maximale Durchflussraten und minimaler Proteinverlust mit Hydrosart®-Membranen

Polyethersulfone Microfilter von Sartorius
Biotechnologische Filtration leicht gemacht
Hochstabile 0,1 µm PESU-Membranen für maximale Effizienz

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.