Mensch gegen Virus – ein molekulares Wettrennen
Immunologen entdecken neuen Angriffspunkt, um ein weitverbreitetes Virus zu bekämpfen
Die meisten Menschen infizieren sich mit dem humanen Cytomegalie-Virus (CMV) – aber unser Immunsystem hat sich einiges einfallen lassen, um sich gegen das Virus zu wehren. Zukünftig könnte es dabei medikamentöse Unterstützung bekommen. Die Idee dafür stammt von Wissenschaftlern des Helmholtz-Zentrums für Infektionsforschung (HZI): Sie entschlüsselten im Detail, wie CMV infizierte Zellen am Leben erhält – obwohl sie eigentlich ein Selbsttötungsprogramm durchlaufen und dabei die von ihnen abhängigen Viren mit in den Tod reißen sollten. Überlebt die Zelle, kann sich das Virus besser im Körper verbreiten.
Obwohl die meisten von uns lebenslange Träger des Herpesvirus CMV sind, wird die Infektion vom Immunsystem kontrolliert und bleibt ohne Symptome. Ist das Immunsystem jedoch geschwächt, beispielsweise nach einer Organtransplantation oder auch bei AIDS-Patienten, kann CMV zum Problem werden. Bislang war unklar, warum das Immunsystem die Infektion in diesen Fällen nicht mehr unter Kontrolle halten kann. Forscher des HZI haben nun mit Kooperationspartnern des Max von Pettenkofer-Instituts in München die Virusabwehr genauer untersucht.
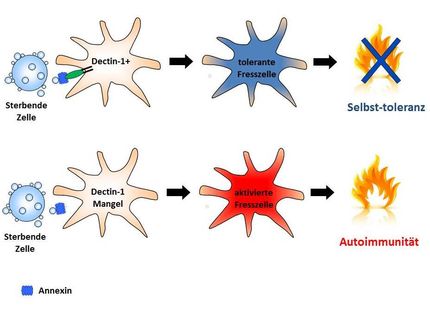
Es ist bekannt, dass das Immunsystem infizierte Zellen zur gezielten Selbstzerstörung bringt. Diese begehen in einem Prozess, der auch Apoptose genannt wird, gewissermaßen Selbstmord. Indem der Körper befallene Zellen frühzeitig opfert, verhindert er, dass sich die Erreger weiter vermehren. Das Zeichen dafür kann von der Zelle selber kommen oder von außen durch Zellen des Immunsystems gegeben werden. Diesen zweiten Fall haben die Immunologen genauer untersucht. Das Signal zum Selbstmord erhalten die Zellen über sogenannte „Todes-Rezeptoren“, die auf der Oberfläche der Zellen zu finden sind.
„Wir haben herausgefunden, welche Immunzellen das Signalmolekül aussenden, das dort andockt“, so Dr. Linda Ebermann, Wissenschaftlerin am HZI. Das „Todes-Signal“ stammt von Makrophagen, den Fresszellen des Immunsystems, die eingedrungene Erreger regelrecht vertilgen. Aktivierte Makrophagen wandern zum Entzündungsherd, wo sich die Virus-infizierten Zellen befinden. Dort schütten sie bioaktive Moleküle aus, die umgebende Zellen in den Tod schicken können. Dass sie auf diese Weise zur Virenbekämpfung beitragen, war bislang nicht bekannt.
Die Immunologen haben nicht nur die Quelle der Signale entdeckt. Sie konnten auch zeigen, wie die evolutionäre Antwort der Viren auf das molekulare Aufrüsten aussieht. „Viren sind keine Lebewesen. Um sich zu vermehren, brauchen sie lebende Wirtszellen“, erläutert Ebermann. „Das Cytomegalie-Virus zwingt infizierte Zellen, ein virales Protein herzustellen, das den zellulären Selbstmord unterdrückt. So kann es sich ungestört vermehren und verbreiten.“
Bei ihrer Studie kam den Forschern zugute, dass es eine Variante von CMV gibt, die spezifisch Mäuse infiziert. Diese ähnelt derjenigen, die Menschen befällt, stark. Genau wie Menschen mit einem geschwächten Immunsystem an CMV erkranken, werden auch immunschwache Mäuse krank, wenn sie mit der Maus-spezifischen Variante infiziert sind. Fehlt den Mäusen ein Teil des Immunsystems, funktioniert die Strategie des Mäusevirus, mithilfe eines Proteins namens M36 das Programm der zellulären Selbsttötung zu stoppen und so das Überleben seiner Wirtszelle zu sichern. Die Chancen sind hoch, dass das menschliche Virus es ganz genauso macht.
„Die Apoptose-hemmenden Proteine, die humanes CMV und Maus-CMV herstellen lassen, ähneln sich stark. Daher gehen wir davon aus, dass wir unsere Erkenntnisse gut auf den Menschen übertragen können“, so Prof. Luka Cicin-Sain, Leiter der Forschungsgruppe „Immunalterung und Chronische Infektionen“ am HZI und Juniorprofessor am Institut für Virologie der MHH.
Im Augenblick hat das Virus in immungeschwächten Menschen die besseren Waffen – der infizierte Mensch erkrankt beispielsweise an Entzündungen des Gehirns, des Darms oder der Netzhaut des Auges. Die Arbeit der HZI-Forscher hat aber die Strategie der Viren aufgedeckt und liefert so einen Anhaltspunkt, wo Medikamente angreifen könnten, um das Immunsystem der erkrankten Menschen zu unterstützen. „Denkbar ist, mit Hilfe von Medikamenten zu verhindern, dass CMV den zellulären Selbstmord blockiert. So nehmen wir dem Virus die Möglichkeit, sich weiter auszubreiten. Das wäre eine große Hilfe für immungeschwächte Menschen, die mit CMV infiziert sind“, unterstreicht Cicin-Sain die Relevanz der Ergebnisse.
Originalveröffentlichung
Linda Ebermann, Zsolt Ruzsics, Carlos A. Guzmán, Nico van Rooijen, Rosaely Casalegno-Garduño, Ulrich Koszinowski, Luka Čičin-Šain; "Block of Death-Receptor Apoptosis Protects Mouse Cytomegalovirus from Macrophages and is a Determinant of Virulence in Immunodeficient Hosts:2, PLOS Pathogens 2012