Kräftemessen mit Influenzaviren
Um neue Medikamente gegen Virusinfektionen zu entwickeln, messen Forscher die Kraft, mit der die Erreger sich an ihre Wirtszellen heften
Jeden Herbst kämpfen wir aufs Neue mit ihnen, viele bleiben nicht verschont: Grippeviren attackieren ständig einen erheblichen Teil der Bevölkerung. Gefährlicher als die relativ harmlosen saisonalen Erreger sind weltweite Ausbrüche von Vogel- und Schweinegrippe, die einem bewusst machen, wie rasend schnell es zu einer Pandemie kommen könnte. In der Arbeitsgruppe „Molekulare Biophysik“ um Professor Andreas Herrmann an der Humboldt-Universität beschäftigen sich Wissenschaftler mit den ersten Schritten der Influenzavirus-Infektion, damit wichtige Prozesse der Virusentwicklung hoffentlich bald blockiert werden können. Eine Frage, die die Wissenschaftler dabei interessiert ist, mit welcher Kraft sich Viren an ihre Wirtszellen heften.
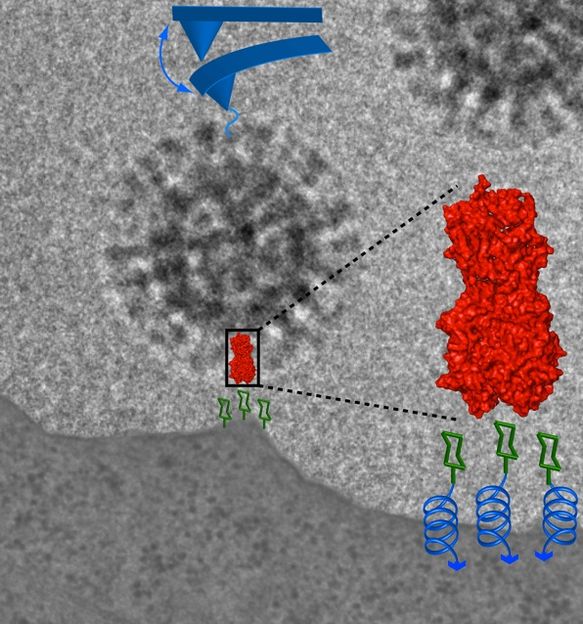
Influenzavirus, das mit seinen Spikeproteinen Hämagglutinin an die Zellmembran einer Wirtszelle (unten) bindet.
Andreas Herrmann
Viren können sich nicht selbstständig reproduzieren. Sie müssen sich in eine Wirtszelle einschleusen, um deren Strukturen für die eigene Vermehrung zu nutzen. Um sich an eine geeignete Zelle zu binden, hat das Virus bestimmte Oberflächenproteine - so genannte Spikeproteine. Eines davon, das Hämagglutinin (HA), bindet an Rezeptoren der Wirtszelle und stellt dadurch den ersten Kontakt her. Die Art des Rezeptors der Wirtszelle bestimmt häufig, welche Zellen infiziert werden können und welche nicht. Dies wird als Zelltropismus bezeichnet und ist in der letzten Zeit sehr stark in den wissenschaftlichen Focus gerückt, insbesondere bezüglich der Verbreitung von H5N1 Vogelgrippeviren. Die H5N1 Infektion beschränkt sich heute bis auf wenige Ausnahmen auf Vögel. Es wird angenommen, dass die Rezeptorspezifität eine entscheidende Barriere darstellt, die das Springen der Viren auf den Menschen verhindert. Wenn diese Hürde aber genommen wird, kann das Vogelvirus für den Menschen sehr gefährlich werden, denn sein Immunsystem ist nicht darauf vorbereitet. Um mehr über die Bindung des Virus an Wirtszellen zu erfahren, hat die HU-Arbeitsgruppe die mechanische Kraft untersucht, mit der sich ein einzelnes Virus an eine lebende Zelle heftet. Doch wie lassen sich solche winzigen Kräfte messen?
Die Wissenschaftler haben mehrere Methoden angewendet, beispielsweise in Zusammenarbeit mit der Berliner Firma JPK Instruments AG eine so genannte optische Pinzette eingesetzt. Mit dieser Pinzette können mikroskopisch kleine Kugeln, auf denen sich wenige Viren befinden, gehalten und mitsamt der Viren an Zellen herangeführt werden, bis es zur Bindung eines Virus an eine Zelle kommt. Danach wird die Kugel zurückgezogen und die resultierende Kraft gemessen. Um die molekulare Grundlage der Kräfte zu verstehen, haben die HU-Biologen diese Experimente mit der Gruppe von Prof. Helmut Grubmüller am Max-Planck-Institut für biophysikalische Chemie am Computer simuliert.
Es stellte sich heraus, dass die Interaktionskraft einer Bindung etwa zehn Piconewton beträgt. Diese Zahl lässt sich mit der Kraft vergleichen, die jede einzelne Person aufwenden müsste, würden alle Menschen der Erde gemeinsam eine Ein-Euro-Münze anheben. Das scheint nicht viel, doch solche winzigen Kräfte haben eine große Bedeutung für den Erreger: Ein Virus muss gleichzeitig viele Bindungen herstellen, um sich stabil an eine Wirtszelle anzuheften. Dieses als Multivalenz bezeichnete Prinzip setzt die Gruppe gemeinsam mit Chemikern um Prof. Rainer Haag (FU Berlin) für das Design entsprechender Hemmstoffe um.
Weiterhin weisen die Ergebnisse daraufhin, dass weniger die Struktur des Rezeptors, sondern viel mehr die Art der Präsentation auf der Zelloberfläche für die Erkennung einer Wirtszelle von Bedeutung sein kann. Zugleich machen sie deutlich, dass die molekularen Ursachen der Wirtszellspezifität nicht allein auf die Erkennung von Rezeptoren auf der Zelloberfläche beschränkt sind, sondern spätere Schritte der Virusinfektion von maßgeblicher Bedeutung sind.
Originalveröffentlichung
Sieben C, Kappel C, Zhu R, Wozniak A, Rankl C, Hinterdorfer P, Grubmüller H, and Herrmann A (2012) Influenza virus binds its host cell using multiple dynamic interactions. Proc Natl Acad Sci USA, 34: 13626-13631