DESY-Röntgenquelle enthüllt Angriffsmechanismus von Herpesvirus
Entschlüsselung von molekularem Köder liefert Ansatz für neue Medikamente
Ein internationales Forscherteam hat mit Hilfe der DESY-Röntgenlichtquelle DORIS III eine wichtige Waffe eines weit verbreiteten Herpesvirus entschlüsselt. Die Untersuchung zeigt, wie das Epstein-Barr-Virus mit einem molekularen Köder die Alarmkette der körpereigenen Immunabwehr lahmlegt. Die Erkenntnisse bieten Ansatzpunkte für die Entwicklung neuer Medikamente, wie die Forscher um Savvas Savvides von der Universität Gent (Belgien) gemeinsam mit Kollegen vom Europäischen Molekularbiologie-Labor EMBL aus Grenoble (Frankreich) und Hamburg im Fachjournal „Nature Structural & Molecular Biology“ schreiben.
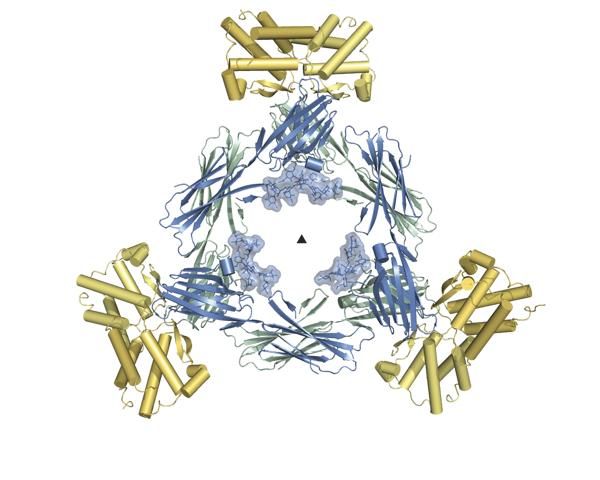
Das reifenförmige BARF1 (blau/grün) bindet drei hCSF-1-Dimere (gelb).
Bild: Savvas Savvides
Das Epstein-Barr-Virus gehört zur Gruppe der Herpesviren und löst unter anderem das Pfeiffersche Drüsenfieber (Mononukleose) aus. Darüberhinaus spielt es bei mindestens einer Krebsart eine Rolle. Der auch als Humanes Herpesvirus 4 bezeichnete Erreger ist extrem weit verbreitet: 90 bis 95 Prozent der erwachsenen Bevölkerung weltweit sind infiziert. Die Infektion verläuft oft symptomlos, und das Virus nistet sich dauerhaft im Körper ein.
Bekannt war bereits, dass der Erreger ein Eiweiß namens BARF1 produziert, mit dem er das Protein hCSF-1 im menschlichen Organismus blockiert. hCSF-1 (humanes CSF-1) ist ein sogenannter Wachstumsfaktor und spielt eine zentrale Rolle bei der Immunabwehr, indem er das Wachstum von Weißen Blutkörperchen (Leukozyten) anregt.
Die Forscher haben mit einer Kombination verschiedener Methoden nun erstmals auf molekularer Ebene aufgeklärt, wie BARF1 das hCSF-1 in die Falle lockt. Dazu durchleuchteten sie BARF1, hCSF-1 und die Kombination aus beiden Proteinen unter anderem mit kurzwelliger Röntgenstrahlung an der European Synchrotron Radiation Facility ESRF, an der Swiss Light Source SLS und beim Deutschen Elektronen-Synchrotron DESY. Die Röntgenstrahlung erzeugt Streubilder der kristallisierten Proteine, aus denen sich deren Struktur detailliert rekonstruieren lässt. An der EMBL-Messstation X33 am DESY-Teilchenbeschleuniger DORIS III gelang es, die Proteine auch in Lösung zu durchleuchten und somit unter Bedingungen zu untersuchen, die ihrer natürlichen Umgebung ähneln. Die Arbeit wurde zum Teil vom Bundesforschungsministerium im Rahmen des SYNC-LIFE-Grants gefördert.
In dem stark interdisziplinären Projekt zeigte sich, dass BARF1 überraschenderweise nicht die aktiven Bindungsstellen des menschlichen Immunproteins besetzt und es so blockiert. Stattdessen greift sich das reifenförmige BARF1 je drei Doppelmoleküle (Dimere) von hCSF-1 an einer neuen Andockstelle und verändert dabei deren Form, so dass sie ihre Funktion nicht mehr erfüllen können. In dieser inaktivierten Form hängen die Dimere an dem Virusprotein fest.
„Der entdeckte Mechanismus zur Modulation der Immunantwort ist tatsächlich einzigartig und sicher das spannendste Resultat dieser Untersuchung“, sagt Dmitri Svergun, der im Rahmen des Projekts die EMBL-Arbeiten in Hamburg geleitet hat. Die Untersuchung in Hamburg hat unter anderem zentrale Informationen zur Struktur von BARF1 vor und nach der Koppelung mit hCSF-1 in seiner natürlichen Umgebung beigetragen. „Die Ausschüttung von BARF1 ist stark mit verschiedenen Krebsarten assoziiert. Um zu verstehen, wie es zu diesen Krankheiten kommt, und mögliche Therapien zu entwickeln, ist es von zentraler Bedeutung, den Prozess aufzuklären, mit dem BARF1 die menschliche Immunantwort beeinflusst.“
„Ein ebenso bedeutender Aspekt unserer Arbeit ist die Entschlüsselung der Art und Weise wie CSF-1 tatsächlich funktioniert“, betont Savvides. „Durch die Untersuchung einer inaktivierten Form von CSF-1 konnten wir verstehen, wie es im Zusammenspiel mit seinem Rezeptor arbeitet.“ Dieses Wissen hat Bedeutung für die Entwicklung von Wirkstoffen, die das CSF-1-Signal beeinflussen, die in einem eigenen klinischen Forschungsfeld durchgeführt wird.