Blutkrebszellen starten Signalkaskade
Forscher decken auf, wie krankhafte Zellen sich bei der Chronischen Lymphatischen Leukämie selbst aktivieren
Anzeigen
Wissenschaftler um Prof. Dr. Hassan Jumaa vom Zentrum für biologische Signalstudien (BIOSS) der Universität Freiburg, Lehrstuhl für Molekulare Immunologie, haben einen neuen Mechanismus entdeckt, der bewirkt, dass hilfreiche Immunzellen in bösartige Krebszellen umgewandelt werden. Bei der Chronischen Lymphatischen Leukämie (CLL), eine der häufigsten Blutkrebserkrankung in der westlichen Welt, tragen die Zellen den Schlüssel für die krankhaften Veränderungen in sich selbst, wie die Forscher in der Zeitschrift „Nature“ berichten. Das Verständnis dieser zugrunde liegenden Mechanismen könnte neue Therapien mit geringeren Nebenwirkungen ermöglichen.
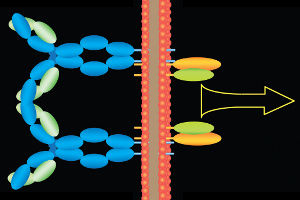
Auf weißen Blutkörperchen von Patienten mit Chronischer Lymphatischer Leukämie docken zwei Rezeptoren an der Außenseite der Zelle aneinander (links, blau dargestellt) und lösen über Bausteine an der Innenseite der Zelle (rechts) eine Signalkaskade aus. Diese ist ein wichtiger Bestandteil der Umwandlung der Immunzelle in eine sich unkontrolliert vermehrende Krebszelle.
Dühren-von Minden
Bei einem gesunden Menschen haben B-Lymphozyten, eine Untergruppe der weißen Blutkörperchen, die Aufgabe, Antikörper zur Abwehr von Infektionen zu produzieren. Spezielle Rezeptormoleküle der B-Lymphozyten erkennen Krankheitserreger über das Schlüssel-Schloss-Prinzip und schalten daraufhin die Produktion von Antikörpern ein. Bei der CLL hingegen führen ungewöhnliche Formen dieser Rezeptoren dazu, dass sich die krankhaften B-Lymphozyten unkontrolliert vermehren und dadurch die gesunden Zellen des Immunsystems verdrängen.
„Bisher wurde vermutet, dass körpereigene Substanzen an diese Rezeptoren andocken und so die CLL-Lymphozyten aktivieren“, sagt Jumaa. „Wir konnten nun zeigen, dass interne Bausteine der Rezeptoren für die Entstehung von CLL verantwortlich sind.“ Bei B-Lymphozyten von CLL-Patienten sind die Rezeptor-Bausteine HCDR3 und FR2 nämlich so geformt, dass sie Schloss und Schlüssel des Rezeptors darstellen. „Hierdurch aktivieren sich benachbarte Rezeptoren derselben Zelle gegenseitig und lösen eine Signalkaskade aus, die schließlich zur unkontrollierten Teilung der Krebszellen führt.“
Als Behandlung für CLL stehen derzeit Ansätze wie eine Chemotherapie zur Verfügung, welche auf relativ unspezifische Weise die Symptome der Leukämie unterdrücken. „Basierend auf der Entschlüsselung der molekularbiologischen Grundlagen der CLL wollen wir nun herausfinden, wie wir dieses Wissen für Patientinnen und Patienten nutzbar machen können“, sagt Marcus Dühren-von Minden, ein weiterer Autor der Studie. „Vorstellbar ist es, Patienten in Zukunft vielfache Kopien des Schlüssels FR2 zu verabreichen, welche dann an die Rezeptoren andocken und verhindern, dass benachbarte Rezeptoren aneinander binden. Dies stoppt die folgenreiche Signalkaskade.“ Damit könnte deutlich früher als bisher und ohne größere Nebenwirkungen in den Krankheitsverlauf eingegriffen werden.






















































