Molekulare Interaktionen entschlüsselt: Wie Bakterien sauerstoffabhängig ihre Bewegungsrichtung ändern
Anzeigen
Wie genau einzellige Organismen wie Bakterien es schaffen, auf ihre Umwelt zu reagieren, ist nicht vollkommen verstanden. Neue Erkenntnisse hat Dr. Samir El-Mashtoly vom RUB-Lehrstuhl Biophysik, geleitet von Prof. Dr. Klaus Gerwert, zusammen mit Kollegen aus Japan gewonnen. Im Journal of Biological Chemistry beschreiben die Forscher die molekularen Interaktionen im Bakterium Bacillus subtilis während der Aerotaxis, also der Änderung in der Bewegungsrichtung abhängig von der Sauerstoffkonzentration in der Umgebung. Das Team untersuchte strukturelle Änderungen des Proteins HemAT. Über eine Signalkette sendet es Kommandos an den Motor der Schwimmgeißel des Bakteriums.
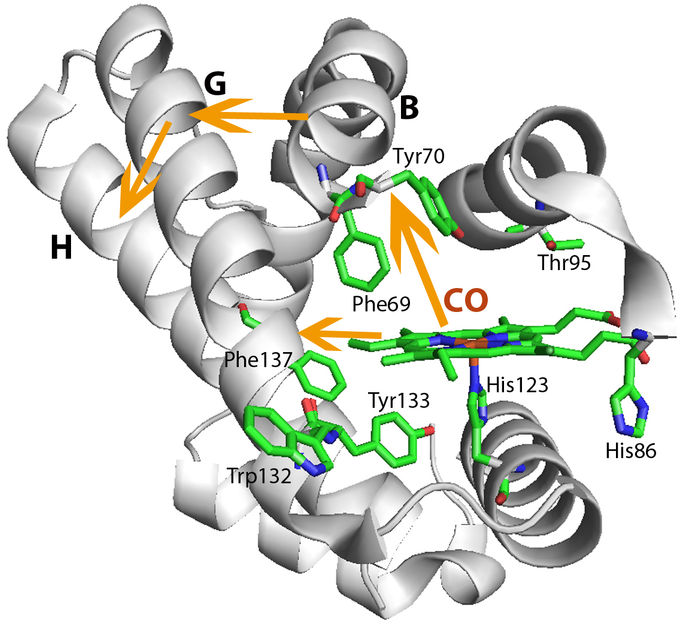
Strukturelle Änderungen in HemAT: Wenn Sauerstoff an die sensorische Domäne bindet (aus methodischen Gründen wurde das Experiment mit Kohlenmonoxid, CO, anstatt mit Sauerstoff durchgeführt), ändert sich die Proteinstruktur in der Umgebung der sensorischen Domäne. Dadurch verschieben sich Helix B und G. Das wiederum beeinflusst die benachbarte H-Helix, die sich bis in die Signal-Domäne fortsetzt.
© Samir El-Mashtoly
Signalübertragungskette
Zunächst bindet Sauerstoff an die Häm-Gruppe von HemAT; diese Gruppe ist auch aus dem Hämoglobin roter Blutkörperchen bekannt und wird als „sensorische Domäne“ von HemAT bezeichnet. Durch die Bindung ändert sich die Struktur der sensorischen Domäne. Das löst weitere strukturelle Veränderungen in HemAT aus, die letztendlich die Signal-Domäne des Proteins erreichen. Die Signal-Domäne überträgt dann die Information über die steigende Sauerstoffkonzentration an weitere Proteine in der Zelle. Diese Proteine leiten die Botschaft an den Motor der Schwimmgeißel weiter. Das Forscherteam untersuchte, wie die Information innerhalb von HemAT von der sensorischen Domäne zur Signal-Domäne wandert.
Proteinhelices übermitteln die Botschaft
Zu diesem Zweck nutzte Dr. El-Mashtoly die Einrichtung für zeitaufgelöste Ultraviolett-Resonanz-Raman-Spektroskopie am Picobiology Institute in Japan. Mit dieser Methode lassen sich zum Beispiel strukturelle Informationen über das Protein und Interaktionen von Wasserstoffbrückenbindungen verfolgen – auf einer Nano- bis Mikrosekunden-Zeitskala. Die Ergebnisse legen nahe, dass die strukturellen Änderungen in der sensorischen Domäne, also der Häm-Gruppe, zwei Proteinhelices in HemAT verschieben. Diese Verschiebung beeinflusst eine weitere Helix, die bis in die Signal-Domäne hineinragt. Über eine Serie von strukturellen Änderungen erreicht also die Information über die Sauerstoffbindung die Signal-Domäne.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!





















































