Schwachstelle eines gefährlichen Krankenhaus-Keims
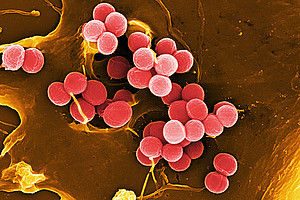
Wenn es um gefährliche Antibiotika-resistente Erreger im Krankenhaus geht, taucht früher oder später der Name Staphylococcus aureus auf. Ein Angriffspunkt für die Entwicklung neuer Wirkstoffe speziell gegen dieses Bakterium ist das Enzym FabI. Dessen Struktur haben Forscher des Würzburger Rudolf-Virchow-Zentrums eingehend charakterisiert – und Hinweise darauf gefunden, warum Staphylococcus aureus auf eine Hemmung dieses Enzyms anfälliger reagiert als andere Bakterienarten.

Am Computermodell fiel Johannes Schiebel auf, wie vergleichsweise flexibel das Enzym FabI bei Staphylococcus aureus ist.
Foto: Rudolf-Virchow-Zentrum
Normalerweise ist Staphylococcus aureus ein harmloses Hautbakterium. Seit Jahren aber schon gibt es Stämme, die kaum noch auf vorhandene Antibiotika reagieren. Sie sind „multi-resistent“ und unter der Abkürzung MRSA gefürchtet. Denn bei Patienten mit geschwächtem Immunsystem können sie zu gefährlichen Blut- oder Lungenentzündungen führen.
Neue Wirkstoffe speziell gegen Staphylococcus aureus haben deshalb in der pharmazeutischen Forschung einen hohen Stellenwert. Ein möglicher Angriffspunkt ist das Enzym FabI, das an der Herstellung von Fettsäuren für die bakterielle Zellhülle beteiligt ist. Forscher des Würzburger Rudolf-Virchow-Zentrums haben jetzt entdeckt, warum Staphylococcus aureus auf eine Hemmung dieses Enzyms anfälliger reagiert als andere Bakterienarten.
Die Daten ihrer Röntgenstrukturanalyse zeigen, dass FabI bei Staphylococcus aureus deutlich anders aussieht als bei anderen Bakterienarten. „Das Enzym sah sehr flexibel aus“, erinnert sich Johannes Schiebel, der den Großteil der Experimente für seine Doktorarbeit durchgeführt hat. Einige Windungen des Moleküls hatten offenbar ungewöhnlich viel Spielraum. Und ganze Teilstücke waren auf dem einen Bild aus- und auf dem nächsten eingeklappt – als wäre ein Bewegungsablauf in einzelnen Standbildern eingefangen.
Schiebel recherchierte und fand Hinweise, dass Staphylococcus aureus – anders als die meisten anderen Bakterien – in seine Zellmembran mit Vorliebe verzweigte Fettsäuren einbaut. Schiebels Doktormutter Prof. Caroline Kisker erklärt den Zusammenhang: „Es liegt nahe, dass ein Enzym mehr Möglichkeiten braucht, sich anzupassen, um verzweigte Fettsäuren verarbeiten zu können – die sind einfach sperriger.”
Einen Verknüpfungspunkt fand Johannes Schiebel mit Hilfe von Kollegen im Labor von Peter Tonge an der Stony Brook University in New York. Die Amerikaner zeigten, dass das FabI-Enzym aus Staphylococcus aureus tatsächlich verzweigte Fettsäuren viel besser verarbeiten kann als die entsprechenden Enzyme aus anderen Bakterienarten.
Verzweigte Fettsäuren kommen – im Gegensatz zu unverzweigten – im Blut von Säugetieren kaum vor. Und vorhandene Studien enthielten bereits Hinweise, dass sie entscheidend für das Überleben der Bakterien sein können, wenn diese nicht unter idealen Laborbedingungen gedeihen können, sondern sich zum Beispiel gegen Angriffe des Immunsystems wehren müssen.
„Damit liefern wir zum ersten Mal eine Hypothese für den tieferen Grund, warum FabI für das Überleben von Staphylococcus aureus entscheidend ist“, erklärt Schiebel, „und warum es Sinn macht, dass Pharmafirmen an Hemmstoffen gegen das Enzym arbeiten.“ Von dreien weiß der junge Grundlagenforscher, die gerade in klinischen Studien zum ersten Mal an Patienten getestet werden. Er hofft, dass die Hersteller dieser möglichen neuen Medikamente durch seine Ergebnisse stimuliert werden: „Das wäre für mich eine große Bestätigung.“
Die Arbeitsgruppe und ihre Kooperationspartner suchen derweil weiter nach den Hemmstoffen der übernächsten Generation, die FabI noch besser blockieren.