Neues Enzym der Immunabwehr entdeckt
Eine bislang unbekannte Serinprotease gehört zum antibakteriellen Abwehrarsenal neutrophiler Granulozyten
Anzeigen
Neutrophile Granulozyten sind wichtige Schutztruppen des Immunsystems. Dringen krankheitserregende Bakterien in den Körper ein, sind sie als Erste vor Ort, um über Signalstoffe weitere Immunzellen zu mobilisieren und die Gefahr einzudämmen. Dazu geben sie Serinproteasen ab – Enzyme, die andere Proteine zerschneiden und Signalmoleküle dadurch aktivieren können. Forscher am Max-Planck-Institut für Neurobiologie in Martinsried haben nun eine neue Serinprotease entdeckt: die Neutrophilen-Serinprotease 4, kurz NSP4. Das Enzym könnte einen neuen Ansatzpunkt für die Behandlung von Krankheiten bieten, bei denen das Immunsystem überaktiv ist, z.B. rheumatoider Arthritis.
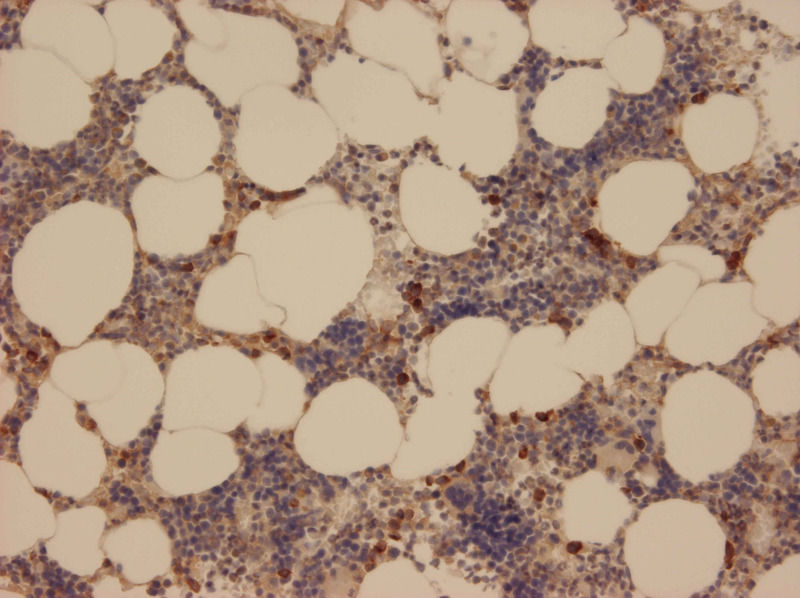
Mikroskopische Aufnahme von normalem menschlichen Knochenmark mit Anfärbung der NSP4 in Myeloblasten und Myelozyten. Die braune Farbablagerung auf den positiven Zellen ist ein unlöslicher Farbstoff, der mit Hilfe des Enzym-markierten zweiten Antikörpers auf den entsprechenden Zellen erzeugt wird. Die Kerne der Knochenmarkszellen sind zusätzlich blau angefärbt. Bei der Aufbereitung des Gewebeschnittes geht das Knochenmarksfett verloren und hinterlässt rundliche Hohlräume.
© MPI für Neurobiologie
Das Immunsystem beruht auf einem komplizierten Zusammenspiel von verschiedensten Zellen und Botenstoffen. So geben etwa die neutrophilen Granulozyten – eine Gruppe von spezialisierten weißen Blutkörperchen – als Reaktion auf Bakterien sogenannte Serinproteasen ab. Diese Enzyme sind in der Lage, Signalmoleküle wie etwa die Chemokine zu aktivieren, indem sie an einer spezifischen Stelle ein Stück des Moleküls abspalten. Die aktiven Signalstoffe lotsen daraufhin weitere Immunzellen zum Entzündungsherd, um die Krankheitserreger zu vernichten.
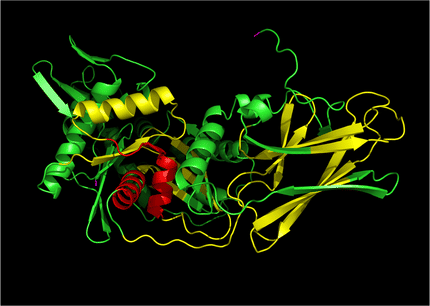
Ein Forscherteam um Dieter Jenne am Max-Planck-Institut für Neurobiologie in Martinsried ist beim Menschen auf eine bisher unbekannte Protease gestoßen: die Neutrophilen-Serinprotease 4 – kurz NSP4. „Das Besondere an diesem Enzym ist, dass es Proteine schneidet, die an einer bestimmten Stelle die Aminosäure Arginin tragen“, sagt Dieter Jenne, Arbeitsgruppenleiter am Martinsrieder Institut. „Damit unterscheidet sich NSP4 von den drei anderen aus den Neutrophilen bekannten Serinproteasen, die zwar in ihrer Molekülstruktur ähnlich sind, aber ein anderes Erkennungsmotiv haben.“ Diesen Unterschied können sich die Forscher womöglich zunutze machen, um einen Wirkstoff zu entwickeln, der NSP4 spezifisch hemmt und dadurch die Immunreaktion herabsetzt.
Denn der Einsatz der Serinproteasen hat seinen Preis. Die Enzyme können nämlich Entzündungen nicht nur heilen, sondern sie manchmal überhaupt erst hervorrufen. Werden zu viele Immunzellen angelockt, greifen diese mit ihrem Arsenal an aggressiven chemischen Waffen auch körpereigenes Gewebe an. Eine Reihe von chronischen Entzündungskrankheiten beruht auf genau diesem Effekt. Wissenschaftler fahnden daher nach Substanzen, mit denen sich die Proteasen der Neutrophilen blockieren lassen. Doch bisher hat es keiner der getesteten Wirkstoffe bis zum fertigen Medikament geschafft.
„Das Substrat von NSP4 kennen wir bisher noch nicht, wir nehmen aber an, dass es sich dabei um Signalstoffe handelt“, sagt Dieter Jenne. Freigesetzte Signalstoffe verstärken im Allgemeinen die Rekrutierung von Neutrophilen, eine überschießende Reaktion kann aber auch Gewebeschäden verursachen. „Proteasen wirken manchmal wie Brandbeschleuniger, die sogar völlig unabhängig von bakteriellen Eindringlingen eine chronische Entzündung auslösen. Indem man die Abwehr drosselt, könnte man diesem Effekt entgegenwirken“, erklärt der Wissenschaftler.
Stammesgeschichtlich ist NSP4 unter allen vier aus den Neutrophilen bekannten Serinproteasen die älteste: Wie die Forscher anhand von Gensequenzen gezeigt haben, hat sich das Enzym in der Evolution von den Knochenfischen bis hin zum Menschen über Hunderte von Millionen Jahren kaum verändert. „Das spricht dafür, dass NSP4 einen fundamentalen Prozess steuert“, sagt Dieter Jenne.
Dass das Enzym bislang unentdeckt blieb liegt daran, dass es in viel geringerer Konzentration vorkommt als die drei anderen Proteasen. Die Max-Planck-Forscher sind darauf gestoßen, als sie im menschlichen Genom nach Genen gesucht haben, die für Serinproteasen kodieren. Dabei ist ihnen eine bis dahin unbekannte Gensequenz aufgefallen. Natascha C. Perera, Wissenschaftlerin in der Martinsrieder Arbeitsgruppe und Erstautorin der Studie, ist es gelungen, das Enzym in seiner aktiven, gefalteten Form herzustellen und zu untersuchen.
Um die NSP4 in Zukunft möglicherweise als Zielprotein für entzündungshemmende Arzneimittel zu etablieren, müssen die Wissenschaftler nun seine Funktion im lebenden Organismus untersuchen und herausfinden, ob sich eine Blockade des Enzyms nachteilig auswirkt. Die Forscher arbeiten mit der Firma Novartis zusammen, um diese Fragen an Mäusen zu klären. „NSP4-Inhibitoren könnten bei Krankheiten wie der chronischen Arthritis oder bei entzündlichen Hautkrankheiten eingesetzt werden“, sagt Dieter Jenne. „Dazu müssen wir aber zuerst die Langzeitwirkungen solcher Wirkstoffe testen.“