Essenzielles Protein für Gefäßneubildung identifiziert
Wie Zellen während der Entwicklung von neuen Gefäßen ihren Kontakt zueinander regulieren, zeigt das Forschungsteam um Manuela Baccarini von den Max F. Perutz Laboratories der Universität Wien. Erstmals wurde die Rolle des Proteins Raf-1 für die Stabilität von Zell-Zell Verbindungen nachgewiesen. Fehlt Raf-1, verlieren die Zellen ihren Zusammenhalt und die Gefäßneubildung ist gehemmt.
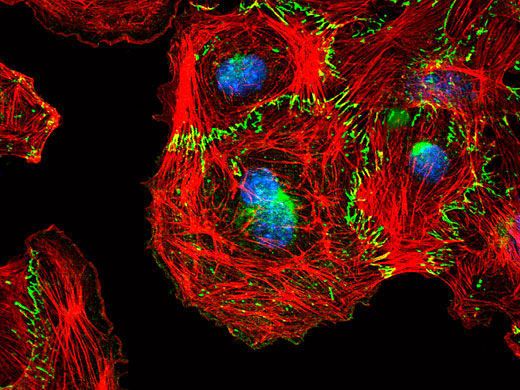
Mikroskopische Aufnahme entstehender Zellkontakte zwischen Endothelzellen. Das Transmembranprotein VE-Cadherin (grün) vermittelt die Bildung von zellulären Kontakten und ist mit dem intrazellulären Aktinzytoskelett (rot) verbunden. Zellkerne sind blau gefärbt.
Reiner Wimmer
Angiogenese ist der Prozess, durch den neue Blutgefäße aus bestehenden Gefäßen gebildet werden. Sie ermöglicht die Entwicklung des Herz-Kreislauf-Systems im Embryo und ist von entscheidender Bedeutung für die Geweberegeneration bei Erwachsenen. Bei der Angiogenese sprossen Zellen von bereits vorhandenen Gefäßen ab und bilden so neue Gefäße. Die Zellen bewegen sich dabei gemeinsam, also in ständigem Kontakt zueinander. Dieser Prozess wird auch von Tumoren missbraucht, um ihr Wachstum zu fördern.
Protein Raf-1 steuert Stabilität von Zell-Zell Kontakten bei Neubildung von Gefäßen
Die Forschungsgruppe um Manuela Baccarini an den Max F. Perutz Laboratories der Universität Wien beschäftigt sich mit zellulären Signalkaskaden, also wie Informationen von innerhalb oder außerhalb in der Zelle verarbeitet werden. Ein wichtiger Signalweg läuft über das Protein Raf-1. "Wir untersuchten Endothelzellen denen Raf-1 fehlt und mussten feststellen, dass sie sich normal teilen konnten und auch morphologisch nicht von normalen Zellen zu unterscheiden waren", erklärt Reiner Wimmer, Erstautor der Publikation. Dennoch simulierten die ForscherInnen die Angiogenese mit diesen Zellen im Labor. "Wir waren sehr überrascht, dass Zellen ohne Raf-1 nicht mehr gemeinsam, sondern einzeln wanderten."
Die Bedeutung dieser unerwarteten Entdeckung wurde in weiteren Experimenten klar: Raf-1 reguliert während der Angiogenese direkt an der Zellmembran die Anbindung von anderen Zellen an das interne Zellgerüst über so genannte "Adherens Junctions": Sind die Verbindungen zu schwach, zerfallen die Zellverbände. Sind sie zu stark, können sich die Zellen nicht fortbewegen. Unter der Kontrolle von Raf-1 wird die Stabilität von Zell-Zell Kontakten ständig moduliert, um eine kollektive Wanderung zu ermöglichen.
Gleicher Mechanismus unterstützt Krebsentwicklung
Angiogenese spielt physiologisch hauptsächlich in der Embryonalentwicklung eine Rolle. Tumore missbrauchen diesen eigentlich gutartigen Prozess, um ihr Wachstum zu fördern. Erreicht ein Tumor eine bestimmte Größe, werden ihm die Nährstoffe zu knapp. Er veranlasst dann über chemische Signale, dass neue Gefäße vom Körper gebildet werden, um sie direkt an den Blutkreislauf anzubinden. Derzeitige Forschung in der Antiangiogenese-Therapie konzentriert sich auf VEGF-Signalmoleküle, die vom Tumor abgesondert werden, um die Angiogenese einzuleiten. Die Ergebnisse der Forscher eröffnen einen weiteren Ansatzpunkt: Durch die Hemmung von Raf-1 könnte man den Mechanismus der Gefäßneubildung selbst reduzieren und damit die Anbindung des Tumors an die Nährstoffversorgung des Körpers verzögern oder verhindern.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Kleine Moleküle kommen groß raus - Wissenschaftliches Glanzlicht des Jahres 2002 - Max-Planck-Forscher erhalten für die Entdeckung, dass kleine RNA-Moleküle gezielt die Aktivität von Genen regulieren, den internationalen "Newcomb Cleveland-Preis"

BfR-Studie bestätigt: Kein Glyphosat in Muttermilch nachweisbar - Labore messen mit modernen Analysemethoden keine Rückstände oberhalb der Nachweisgrenze
Palmomentaler_Reflex