Wie die Natur Polyketide „am Fließband“ herstellt
HZI-Forscher entschlüsseln die atomare Struktur wichtiger Wirkstoffproduzenten
Anzeigen
Von tödlichen Giften bis zu heilenden Antibiotika: Eine Vielzahl von Substanzen, die sich in Pflanzen, Pilzen, Bakterien und anderen Organismen finden, gehören zur Klasse der Polyketide. Wie stellt die Natur dieses erstaunlich breite Spektrum von Polyketiden her? Forscher des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI), des Helmholtz-Instituts für Pharmazeutische Forschung Saarland (HIPS) und der Universität des Saarlandes in Saarbrücken sind dem Verständnis dieses Prozesses jetzt einen entscheidenden Schritt näher gekommen: Sie entschlüsselten Struktur und Arbeitsweise eines Enzyms, das einen wichtigen Baustein liefert und ihn für seinen Einbau in das schrittweise wachsende Polyketid-Molekül vorbereitet. Dabei klärten sie erstmals auf, wie dieses Enzym den spezifischen Baustein erkennt, ihn bindet und für seinen Einsatz aktiviert. Die Ergebnisse veröffentlicht „Nature Chemical Biology“ in seiner aktuellen Ausgabe. Für die Zukunft erhoffen sich die Forscher, die Polyketid-Synthese in der Zelle „umprogrammieren“ zu können – und so zu neuen Substanzen mit medizinischer Wirkung zu gelangen.
Die Polyketide bilden eine der größten Naturstoffklassen; viele von ihnen wurden bei der Suche nach neuen biologischen Wirkstoffen gefunden und aus Mikroorganismen oder Pflanzen isoliert. Ihre Funktionen sind äußerst vielfältig: Sie dienen als Signalmoleküle, als Farbstoffe und als Verteidigungswaffen gegen Fressfeinde oder Konkurrenten. Das Antibiotikum Erythromycin, die Krebsmedikamente Doxorubicin und Epothilon sowie das Antiparasiten-Mittel Avermectin sind prominente Vertreter dieser vielfältigen Stoffklasse. So unterschiedlich ihre Struktur und biologische Rolle sein mögen: Die Polyketide in verschiedenen Organismen teilen gemeinsame Wege der Herstellung in der produzierenden Zelle.
Spezielle Enzymkomplexe, sogenannte Polyketid-Synthasen, bilden sie in Mikroorganismen schrittweise durch die Verknüpfung einzelner Bausteine. „Der Zusammenbau von Polyketiden ist reine Fließbandarbeit“, erklärt Professor Rolf Müller, Direktor und Abteilungsleiter am HIPS sowie Professor für Pharmazeutische Biotechnologie an der Universität des Saarlandes. „Man könnte die Polyketid-Synthase mit einer Fertigungsstraße in einer Fabrik vergleichen. Sie erhält ein Bauteil von einer bestimmten Zuliefer-Einheit, das nächste von einer anderen. So wie bei der Produktion eines Autos eine bestimmte maschinelle Einheit nur die Türen bereitstellt, die nächste nur Motorhauben und so weiter. Die Polyketid-Synthase verknüpft dann die Bauteile chemisch miteinander. So entsteht schließlich ein fertiges Polyketid.“
Die Forscher haben sich nun die Zulieferer der einzelnen Bausteine am Beispiel des Bakteriums Streptomyces genauer angesehen. Die Zulieferer sind eine Klasse von Proteinen mit dem komplexen Namen „Crotonyl-CoA-Carboxylase/Reduktase“, kurz CCR. Ihre Aufgabe ist es, die Bausteine für die Synthasen bereit zu stellen. Dabei liefert jede CCR nur einen ganz bestimmten Baustein. „Die Frage war nun: Wie gewährleisten die CCR die erstaunliche Vielfalt von Polyketid-Strukturen?“
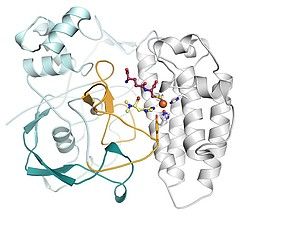
Um diese Frage zu beleuchten, analysierten die Forscher jetzt erstmals die biochemische Funktion und die atomare Struktur einer bestimmten CCR. Sie wählten dafür das Enzym 2-Oktenoyl-CoA Synthase, kurz CinF.
„Wir konnten erstmals in atomarer Auflösung sehen, wie CinF sein Substrat bindet“, sagt Dr. Nick Quade, Wissenschaftler in der Abteilung Molekulare Strukturbiologie am HZI. Eine Tasche im Protein ermöglicht es dem Bindungspartner, direkt mit CinF zu wechselwirken. Schließlich verglichen die Forscher am Computer die Struktur der Bindungstasche von CinF mit derjenigen von weiteren CCRs, die andere Substrate bereitstellen. Deren Bindungstasche ist genau an das jeweilige Substrat angepasst, ähnlich dem Schlüssel-Schloss-Prinzip. Die Forscher stellten fest: Je nach der Größe ihrer Bindungstasche sind manche CCRs auf kurzkettige Moleküle als Substrat spezialisiert, andere „fischen“ sich bevorzugt langkettige Bausteine aus der Umgebung und bereiten sie für den Einbau in das Polyketid vor.
Weil Polyketide oft medizinisch interessante Wirkungen haben, erhoffen sich die Wissenschaftler vom Verständnis ihrer Synthese wichtige Hinweise für die Arzneimittelentwicklung. „Wir wollen verstehen, wie CCRs arbeiten und die einzelnen Bausteine bereitstellen“, erklärt Professor Dirk Heinz, Wissenschaftlicher Geschäftsführer des HZI und Koautor der Veröffentlichung. „In Zukunft könnte es so möglich sein, Medikamente maßgeschneidert herzustellen und bestimmte Bausteine gezielt einzubauen oder zu verändern.“