Proteinbinder geben neue Einblicke in Krankheiten
Der Rolle von Proteinen bei der Entstehung von Krankheiten und Schmerzen sind Forscher der Universität Kassel auf der Spur. Das genaue Verständnis der Wirkmechanismen dieser Eiweißverbindungen gilt als Schlüssel für künftige Bekämpfungsstrategien.
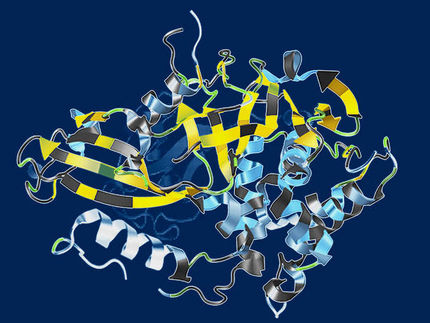
Schmerz und Krankheit auf der Spur: Um die beteiligten Proteine zu identifizieren und untersuchen zu können, charakterisieren Kasseler Forscher designte Binder von der Universität Zürich (Prof. Dr. Andreas Plückthun) auf ihre Interaktion mit Proteinen. So sieht eine Kristallstruktur von einem Protein (großes, buntes Molekül) und ein dazu generierter, designter Binder (klein, rot, links unten) aus.
Urheber PDB: 3NOG
Die Medizin von morgen soll Krankheiten früher und gezielter bekämpfen oder sogar bereits deren Ausbruch vermeiden können. Auf dem Weg dorthin nehmen Proteine eine Schlüsselstellung ein, wobei jede menschliche Zelle aus einem fein abgestimmten Orchester an unterschiedlichsten Proteinen besteht. Dabei ist einerseits wichtig, welche Proteine dies sind, und zum anderen, wie viele Proteine einer Spezies vorhanden sind, da die Proteinzusammensetzung letztlich für die Funktion entscheidend ist. Wissenschaftler der Universität Kassel analysieren im Rahmen mehrerer Forschungsprojekte das Bindungsverhalten dieser wohl wichtigsten Bausteine des menschlichen Organismus. Diese Forschung ist die Grundlage für die Entwicklung neuer Medikamente, das Aufspüren von Schmerzschaltern in Nervenzellen, den gezielten Einsatz von Arzneimitteln und ein besseres Verständnis der Ursache von Krankheiten wie z.B. Parkinson oder Alzheimer.
Warum empfindet ein Mensch stärkere Schmerzen als andere? Wieso gibt es Schmerzen, die scheinbar keine körperliche Ursache haben? Warum helfen bestimmte Medikamente gegen einen Tumor bei dem einen Patienten gut, bei einem anderen aber weniger? Antworten darauf könnte das Netzwerk der schätzungsweise 100.000 verschiedenen Proteine, also Eiweißverbindungen, liefern. Ihr Zusammenspiel in den Zellen und ihre Wechselwirkung untereinander steuern jeden unserer Sinne, jede Funktion, also unseren gesamten Organismus. Bei vielen Krankheiten kann die heutige Medizin nur die Symptome behandeln, sagt Dr. Daniela Bertinetti, wissenschaftliche Mitarbeiterin an dem von Prof. Dr. Friedrich W. Herberg geleiteten Fachgebiet Biochemie der Universität Kassel. Man vermutet, dass eine Reihe von fehlerhaften Proteinen für die Auslösung von Krankheiten verantwortlich sei. „Die Analyse der Proteine hilft uns, besser zu verstehen, wie wir funktionieren“, erklärt die Wissenschaftlerin.
Doch um bestimmte Proteine in einer Gewebeprobe aufzuspüren, ihr Mengenverhältnis zueinander zu bestimmen und die Interaktion der Biomoleküle darzustellen, bedarf es spezieller Binder: Diese maßgeschneiderten Proteine werden im Reagenzglas mit speziellen Bindemotiven versehen, um an diejenigen Proteine im menschlichen Körper andocken zu können, die detektiert werden sollen. Die Wissenschaftler des Fachbereichs Biochemie sind darauf spezialisiert, solche designten Binder herzustellen und ihr Bindeverhalten bis ins Detail zu analysieren. Dabei geht es vor allem darum, den einen Binder mit maßgeschneiderten Eigenschaften aus Tausenden von hergestellten Bindern herauszufiltern. Denn ein Binder taugt nur dann als Werkzeug, wenn z.B. seine Bindung an ein Protein über eine gewisse Zeitdauer hält. Für die Analyse der Bindungseigenschaften von Biomolekülen haben die Kasseler Forscher mehrere methodische Verfahren entwickelt. „Wir haben einen ganzen Zoo von unterschiedlichen Methoden zur Analyse von Bindungen. Unsere Expertise in den so genannten Biomolekularen Interaktionsanalysen ist sowohl national als auch international ausgewiesen“, sagt Dr. Bertinetti.
Beispielsweise nutzen die Wissenschaftler das physikalische Prinzip der Oberflächenplasmon Resonanz (SPR) um das Binde- und Abstoßungsverhalten von Biomolekülen zu messen. Für manche Fragestellungen braucht man allerdings eine Messmethode in lebenden Zellen, da nutzen die Kasseler Wissenschaftler den so genannten BRET (Biolumineszenz-Resonanz-Energie-Transfer) Assay.
Außerdem entwickeln die Kasseler Biochemiker in Zusammenarbeit mit Forschern aus ganz Europa und der Unterstützung von Professor Dr. Hartmut Hillmer vom Institut für Nanostrukturtechnologie und Analytik (INA) der Universität Kassel im Rahmen von CINSaT ein „Lab on a chip“ Verfahren, den so genannten DNA array to protein array (DAPA). Mit diesem Verfahren könnte man die Bindung von tausenden Proteinen an maßgeschneiderte Binder im Labor schnell, einfach und kostengünstig charakterisieren.
Um zu gezielteren Behandlungsmethoden zu kommen, müssen zunächst die Gesamtheit der menschlichen Proteine, ihr Mengenverhältnis in der Zelle und ihre Wechselwirkung charakterisiert werden. Einen Beitrag dazu leisten die Kasseler Wissenschaftler seit 2010 in dem mit 11 Millionen Euro dotierten, noch bis Ende 2014 laufenden EU-Projekt „Affinomics“, in dem 15 europäische Forschungseinrichtungen zusammenarbeiten. 400.000 Euro Forschungsgelder fließen dafür nach Kassel. Schon bei dem - mit 3 Millionen Euro dotierten - Vorläufer-Projekt „Affinity Proteome“ waren das Fachgebiet und das am Standort ansässige Biotech Unternehmen Biaffin GmbH & Co KG dabei.
Bei der Forschung nach der Ursache von Schmerzen arbeiten die Kasseler Wissenschaftler im Rahmen des vom Bundsministerium für Bildung und Forschung mit zwei Millionen Euro geförderten Projektes „Modellierung von peripheren Schmerzschaltern“ mit acht Forschungseinrichtungen und einem mittelständischen Unternehmen interdisziplinär zusammen. Bioinformatiker, Kliniker und Biochemiker untersuchen dabei die Struktur der Signale, mit denen Proteine die Informationen in den Nervenzellen transportieren, die schließlich das Phänomen Schmerz auslösen. Die bisherigen Ergebnisse belegen, dass die Schmerzweiterleitung deutlich komplexer ist, als zu Beginn des Projektes angenommen. Trotzdem konnten in diesem Projekt Signalwege aufgeklärt werden, die Hinweise darauf geben, wie man die Weitergabe von Schmerzimpulsen an bestimmten Stellen pharmakologisch unterbrechen kann.