Durch Verformung zur Toleranz
Wie Bakterien mit der Sauerstoffempfindlichkeit ihrer Enzyme umgehen
Die Medien verkünden das kommende Wasserstoff-Zeitalter - aber erwähnen selten die Quelle für diesen umweltfreundlichen Energieträger. Wasserstoffgas ist in der Erdatmosphäre praktisch nicht vorhanden; derzeit wird es fast ausschließlich aus fossilen Energiequellen (Erdgas) erzeugt. Für den riesigen Bedarf einer zukünftigen „Wasserstoffwirtschaft“ sollte es durch Spaltung des reichlich vorhandenen Wassers auf der Erde durch Sonnenlicht regenerativ erzeugt werden. Dies erfordert Entwicklung und Einsatz geeigneter Katalysatoren, an denen weltweit intensiv gearbeitet wird.
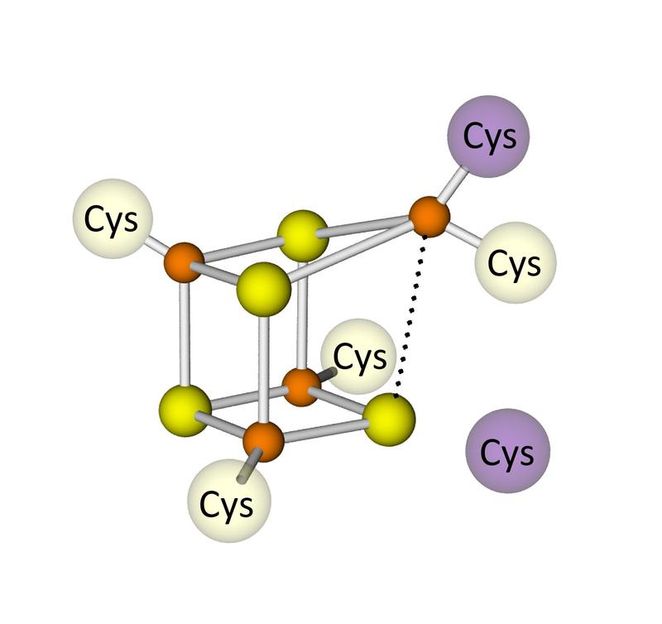
verzerrter Eisenschwefelcluster
MPI für Bioanorganische Chemie
Dabei suchen Wissenschaftler auch in der Natur nach Ideen - schließlich hatte diese Millionen von Jahren Zeit zur Optimierung ihrer Biokatalysatoren (Enzyme). Lichtinduzierte Wasserspaltung findet täglich durch Photosynthese in allen grünen Pflanzen, Algen und einigen Bakterien im sogenannten „Photosystem 2“ statt. Zur Produktion oder Verarbeitung von Wasserstoff nutzt die Natur die Hydrogenasen: Proteine, die Eisen (und oft auch auch Nickel) in einer komplexen Umgebung enthalten.
Leider sind diese Proteine sehr empfindlich gegenüber Sauerstoff. Als kürzlich Hydrogenasen entdeckt wurden, die ihre katalytische Aktivität auch an Luft beibehalten, haben sich Forscher auf die Suche nach möglichen Gründen für diese bemerkenswerte „Sauerstofftoleranz“ gemacht. Bei der Untersuchung des Elektronentransfers einer [NiFe]-Hydrogenase aus dem hitzestabilen Bakterium Aquifex aeolicus (einer Mikrobe, die nahe Unterwasservulkanen lebt und sich selbst bei 95 Grad sehr wohlfühlt) entdeckten Forscher des Instituts in Kooperation mit einer Forschergruppe aus Marseille einen ungewöhnlichen Eisen-Schwefel-Cluster mit verzerrter Würfelstruktur, der ganz besondere Eigenschaften aufweist, nämlich zwei Elektronenübergänge ausführen kann. Dies ist bisher noch nie für einen Cluster dieser Art beschrieben worden und kann auf seine besondere Struktur (Bindung durch sechs anstelle von nur vier Aminosäuren des Typs Cystein, Cys; siehe Abbildung) zurückgeführt werden.
Offensichtlich steht diese neuartige Clusterstruktur, die auch in anderen Bakterien mit diesen Eigenschaften vermutet wird, in direktem Zusammenhang mit der bemerkenswerten Toleranz dieses Enzyms gegenüber molekularem Sauerstoff. An der endgültigen Klärung dieses Phänomens auf molekularer Ebene wird intensiv gearbeitet; sie ist von zentraler Bedeutung für den biotechnologischen Einsatz dieser Enzymklasse bzw. für den Bau von biomimetischen (der Natur nachempfundenen) Katalysatoren zur Wasserstoffgewinnung durch die mit Sonnenlicht getriebene Wasserspaltung.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Maria-Eirini Pandelia, Wolfgang Nitschke, Pascale Infossi, Marie-Thérèse Giudici-Orticoni, Eckhard Bill, and Wolfgang Lubitz; "Characterization of a unique [FeS] cluster in the electron transfer chain of the oxygen tolerant [NiFe] hydrogenase from Aquifex aeolicus"; PNAS
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.