Vertrauen ist gut, Transkriptionsfaktoren sind besser
Viele angeborene Herzerkrankungen beruhen auf fehlerhafter Protein-Kontrolle
Anzeigen
Angeborene Herzfehler sind häufige Herzerkrankungen des Menschen. Damit sich ein Herz korrekt entwickelt, muss einerseits das Erbgut möglichst fehlerfrei vorliegen. Zum anderen muss der genetische Bauplan korrekt in die einzelnen Bauelemente – die Proteine – übersetzt werden. Forscher am Max-Planck-Institut für molekulare Genetik in Berlin unter der Leitung von Silke Sperling haben nun das Zusammenspiel der daran beteiligten Faktoren im Detail untersucht. Ihre Ergebnisse zeigen, dass die an der Herzentwicklung beteiligten Gene auf mehreren Ebenen reguliert werden. Nur wenn die richtigen Proteine in der richtigen Menge zum richtigen Zeitpunkt gebildet werden, kann ein funktionstüchtiges Herz entstehen.
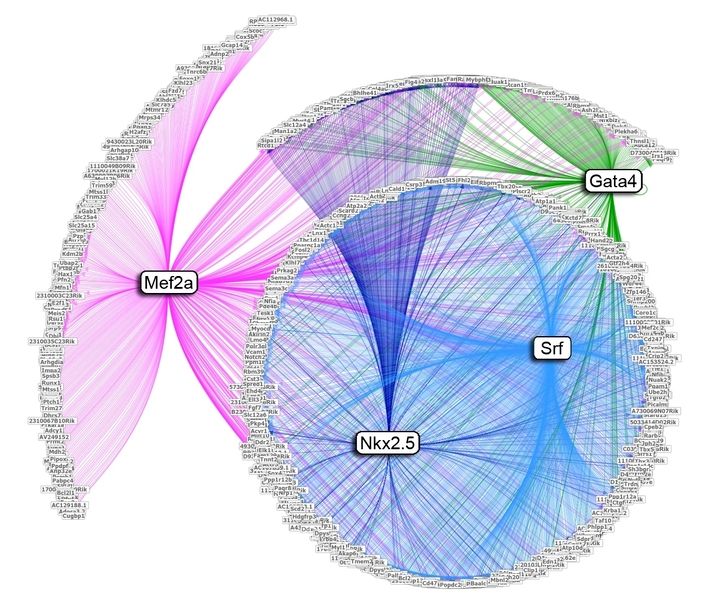
Zielgene der Transkriptionsfaktoren Gata4, Mef2a, Nkx2.5 und Srf in der Herzmuskelzelle der Maus. Dargestellt sind insgesamt 1600 Gene wovon ca. 30% eine gemeinsame Regulation durch zwei oder mehrere der untersuchten Faktoren aufweisen. Die kombinatorische Bindung der Transkriptionsfaktoren an die regulatorischen Sequenzen der Zielgene erfolgt dabei in enger Nachbarschaft.
© MPI für molekulare Genetik
Das Erbgut enthält zwar in seinen Genen den Bauplan eines Organismus, zunächst muss die in der DNA gespeicherte Information jedoch abgelesen und in Proteine übersetzt werden. Diese Proteine steuern Wachstum, Teilung und die korrekte Funktion einer Zelle. Doch damit eine Zelle korrekt funktioniert, dürfen nicht alle Proteine in unbegrenzten Mengen hergestellt werden. Ihre Produktion muss vielmehr exakt aufeinander abgestimmt sein, so dass die Zelle je nach Entwicklungsstufe nur die gerade gebrauchten Proteine produziert.
Die Zelle reguliert die Proteinbildung mit Hilfe so genannter Transkriptionsfaktoren. Diese Proteine binden an spezielle Aktivierungsbereiche der DNA und schalten damit gezielt das Ablesen einzelner Gene an oder aus. Die Feinabstimmung der Genaktivität durch Transkriptionsfaktoren ist absolut lebenswichtig. Fehlen bestimmte Faktoren, kann es zu erheblichen Fehlbildungen kommen.
Die Entwicklung des Herzens ist ein Beispiel dafür, wie wichtig Transkriptionsfaktoren für die Entwicklung eines Organismus sind. Es ist das erste voll funktionsfähige Organ im Embryo. Eine kleine Gruppe aus Transkriptionsfaktoren bestimmt wesentlich das Wachstum der Herzmuskelzellen. Sind auch nur einzelne Faktoren defekt, ist das Herzwachstum gestört und der Embryo stirbt oft bereits in einem frühen Entwicklungsstadium.
Die Forscher bestimmten zunächst für isolierte Herzmuskelzellen, wo jeder einzelne Faktor an die DNA bindet. Sie fanden heraus, dass allein der Transkriptionsfaktor Srf an über 1300 verschiedene Stellen bindet und damit die Ableserate von mehr als 1000 Genen beeinflusst. Im nächsten Schritt schalteten die Wissenschaftler einzelne Transkriptionsfaktoren aus, um festzustellen welche Gene dadurch weniger häufig abgelesen wurden. „Viele Gene wurden tatsächlich deutlich weniger abgelesen. Doch in einigen Fällen binden mehrere Transkriptionsfaktoren an dasselbe Gen“, sagt Silke Sperling vom Max-Planck-Institut für molekulare Genetik, „dadurch kann der Ausfall eines Faktors zum Teil von anderen Faktoren ausgeglichen werden.“
Zusätzliche Kontroll-Instanzen
Außerdem konnten die Wissenschaftler zeigen, dass Transkriptionsfaktoren die Genaktivität nicht nur direkt durch ihre Bindung an die DNA steuern, sondern auch indirekt auf mindestens zwei weiteren Ebenen. So beeinflusst der Transkriptionsfaktor Srf, wie zugänglich „seine“ Gene sind. Denn die DNA liegt nicht als loser Molekül-Strang vor, sondern ist um Strukturproteine – die Histone – gewickelt. Je nachdem, wie stark diese Histone an die DNA binden, ist der Strang locker oder dicht gepackt und kann entsprechend abgelesen werden. Srf scheint nicht nur an die DNA selbst, sondern auch Enzyme zu regulieren, die die Histone chemisch verändern und so das Ablesen der DNA erleichtern oder erschweren. Zusätzlich steuert Srf die Proteinproduktion auch über kurze RNA-Moleküle – so genannte mikro-RNA. „In den Zellen mit abgeschaltetem Srf könnten Unterschiede in der mikro-RNA-Menge für rund die Hälfte der veränderten Genaktivität verantwortlich sein“, erklärt Silke Sperling.
Transkriptionsfaktoren in den Herzmuskelzellen steuern die Zellen also auf drei Ebenen: direkt über Bindung an die DNA sowie indirekt über Histone und mikro-RNA. Bislang dachte man, die beiden indirekten Ebenen würden die Genaktivität lediglich modulieren, aber zumindest in den Herzmuskelzellen sind alle drei Ebenen gleichberechtigt. Die gewonnenen Daten der Berliner Wissenschaftler erweitern unser Verständnis für angeborene Herzerkrankungen und können Grundlage für neue Therapiemethoden bei anderen Herzerkrankungen sein. „Nur wenn wir das komplexe Zusammenspiel der verschiedenen Ebenen der Genregulation im Detail kennen, können wir gezielt Medikamente entwickeln“, so Silke Sperling.























































